
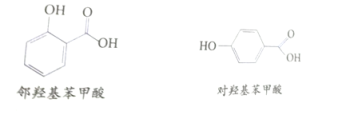
【题目】如图是两种具有相同分子式的有机物—邻羟基苯甲酸和对羟基苯甲酸的结构式。已知它们的沸点相差很大,你认为哪一种沸点较高?______________,如何从氢键的角度来解释?______________
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下图是第三周期主族元素的某些性质随原子序数变化的柱形图,则y轴可表示( )
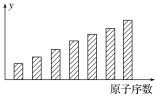
①第一电离能②电负性 ③原子半径 ④简单离子半径 ⑤最高正化合价 ⑥形成简单离子转移的电子数
A.①②③④⑤⑥B.①②③⑤
C.②④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是
A.锗不能与强碱溶液反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。
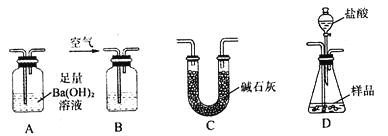
请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液 b.蒸馏水
c.浓硫酸 d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式。
(1)![]() ___;
___;
(2)![]() ___;
___;
(3)CH3CH(CH3)C(CH3)2(CH2)2CH3___;
(4) ___;
___;
(5)2,5-二甲基-4-乙基庚烷__;
(6)2-甲基-2-戊烯____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志有几个( )
2HI(g)已经达到平衡状态的标志有几个( )
①c(H2)=c(I2)=c(HI)时②c(H2):c(I2):c(HI)=1:1:2时③c(H2)、c(I2)、c(HI)不再随时间而改变④单位时间内生成nmolH2的同时生成2nmolHI⑤单位时间内生成n mol H2的同时生成n mol I2⑥反应速v(H2)=v(I2)=1/2v(HI)⑦一个H-H键断裂的同时有两个H-I键断裂⑧温度和体积一定时,容器内压强不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化条件一定,混合气体的平均相对分子质量不再变化
A. 3B. 4C. 5D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是
A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023
B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1
D.30 g HCHO被氧化时转移电子数目为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计 ______(填“合理”或“不合理”),理由是______。
。此设计 ______(填“合理”或“不合理”),理由是______。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
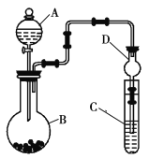
(1)仪器A的名称为______,干燥管D的作用是______。
(2)实验室中现有药品:![]() 溶液、
溶液、![]() 、浓盐酸、
、浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为______、______、______,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______。
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为______、______、______,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______。
(3)若要证明非金属性:![]() ,则A中加______,B中加
,则A中加______,B中加![]() ,C中加______,观察到C中的现象为______。
,C中加______,观察到C中的现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在AlCl3溶液中滴加过量的氨水,反应的化学方程式为__________________。
(2)碳酸氢钠与稀硫酸反应的离子方程式__________________;铜与浓硫酸共热反应的化学方程式__________________。
(3)现有0.284kg质量分数为10%的Na2SO4溶液,则溶液中Na2SO4的物质的量为______;配制250mL2.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积_________mL。
(4)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子的电子层数逐渐____________,原子半径逐渐____________;失电子能力逐渐____________,金属性逐渐____________ ;得电子能力逐渐 ___________,非金属性逐渐____________ 。
(5)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;E元素原子最外层电子数比次外层电子数少1。回答下列问题:
写出E元素的元素符号:________画出B、C的原子结构示意图:B.________C________画出D的离子结构示意图:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com