
| A、2H2(g)+O2(g)═2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1kJ/mol S(s)+O2(g)═SO2(g)△H=-Q2kJ/mol | ||||
| C、C(s)+1/2O2(g)═CO(g)△H=-Q1kJ/mol C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol | ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol
|


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、O2、CO2、H2 |
| B、N2、H2、H2O(g)、CO |
| C、NH3、Cl2、HCl、H2 |
| D、CO、CO2、O2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B2H6(g)+302(g)═B2O3(s)+3H2O(l)△H=2165 kJ?mol-1 |
| B、B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165 kJ?mol-1 |
| C、B2H6+3O2═B2O3+3H2O△H=-2165 kJ?mol-1 |
| D、B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol |
| B、0.03mol |
| C、0.04mol |
| D、0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、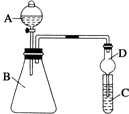 证明非金属性氯>碳>硅(A、B、C中的试剂分别为盐酸、石灰石和硅酸钠溶液) |
B、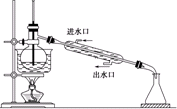 石油分馏 |
C、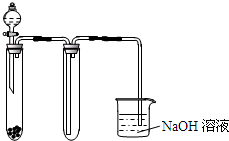 用KMnO4与浓盐酸反应制取适量氯气的简易装置 |
D、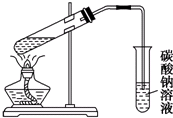 实验室制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、S+O2
| ||||
B、4Al+3O2
| ||||
C、P+O2
| ||||
D、Mg+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、甲烷和苯都不能使酸化的KMnO4溶液褪色,也均不能发生氧化反应 |
| C、乙醇、乙酸、乙酸乙酯都能发生取代反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com