
分析 将镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g.
(1)计算氢氧根的物质的量,可得消耗氢氧化钠的物质的量,进而计算需要氢氧化钠溶液体积;
(2)根据电子转移守恒,则镁和铜的总的物质的量等于氢氧根的物质的量,结合金属的总质量列方程计算;
(3)根据方程式可知参加反应的n(HNO3)=$\frac{8}{3}$n(金属),进而计算硝酸物质的量浓度.
解答 解:将镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g.
(1)氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,则参加反应氢氧化钠的物质的量等于0.3mol,需要氢氧化钠溶液的体积=0.3mol÷3mol/L=0.1L=100mL,
答:完全沉淀时所消耗的NaOH溶液的体积为100mL;
(2)根据电子转移守恒,则镁和铜的总的物质的量为$\frac{0.3mol}{2}$=0.15mol,
设镁和铜的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.15}\\{24x+64y=7.6}\end{array}\right.$
解得x=0.05,y=0.1
则镁的质量为0.05mol×24g/mol=1.2g,铜的质量为0.1mol×64g/mol=6.4g,
答:镁的质量为1.2g,铜的质量为6.4g;
(3)根据方程式可知参加反应的n(HNO3)=$\frac{8}{3}$n(金属)=0.15mol×$\frac{8}{3}$=0.4mol,该硝酸的浓度为$\frac{0.4mol}{0.1L}$=4mol/L,
答:该硝酸的浓度为0.4mol/L.
点评 本题主要考查混合物有关计算,综合考查学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力,是一道考查能力的好题,难度之大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 | D. | 元素非金属性:F>O>N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
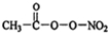 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中一定有化学键断裂,同时也有化学键形成 | |
| B. | 只有共价键的物质一定是共价化合物 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素和非金属元素形成的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53% | B. | 46% | C. | 18% | D. | 36% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com