
科目:高中化学 来源:2013届浙江省绍兴市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列事实中,不能用勒夏特列原理解释的是
A. 溴水中有下列平衡

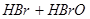 ,当加入
,当加入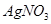 溶液后,溶液颜色变浅
溶液后,溶液颜色变浅
B. 对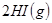

 平衡体系,增大平衡体系的压强可使颜色变深
平衡体系,增大平衡体系的压强可使颜色变深
C. 反应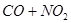

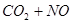 (正反应放热),升高温度可使平衡向逆反应方向移动
(正反应放热),升高温度可使平衡向逆反应方向移动
D. 打开啤酒瓶盖后产生大量的气泡
查看答案和解析>>
科目:高中化学 来源:山东省期中题 题型:单选题
 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深  CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中,不能用勒夏特列原理解释的是 ( )
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
B.对2HI(g) ![]() H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
C.反应CO+NO2![]() CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省兖州市高二上学期期中考试化学试卷 题型:单选题
下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O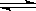 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g) 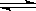 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 |
C.反应CO+NO2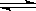 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 |
| D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 |
查看答案和解析>>
科目:高中化学 来源:河北省唐山一中09-10学年度高二第二学期调研考试 题型:单选题
下列事实中,不能用勒夏特列原理解释的是 ( )
A.溴水中有下列平衡Br2+H2O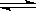 HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
B.对2HI(g) 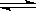 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
C.反应CO+NO2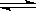 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com