研究NO
2、SO
2、CO等大气污染气体的处理具有重要意义.
(1)NO
2可用水吸收,相应的化学反应方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.利用反应6NO
2+8NH
37N
2+12H
2O也可处理NO
2.当转移1.2mol电子时,消耗的NO
2在标准状况下是
6.72
6.72
L.
(2)已知:2SO
2(g)+O
2(g)?2SO
3(g)△H=-196.6kJ?mol
-12NO(g)+O
2(g)?2NO
2(g)△H=-113.0kJ?mol
-1则反应NO
2(g)+SO
2(g)?SO
3(g)+NO(g)的△H=
-41.8
-41.8
kJ?mol
-1.
一定条件下,将NO
2与SO
2以物质的量比1:2置于密闭容器中发生上述反应,当反应达到平衡状态时,测得NO
2与SO
2物质的量比为1:6,则平衡常数K=
.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H
2(g)?CH
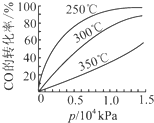
3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H
<
<
0(填“>”或“<”).实际生产条件控制在250℃、1.3×10
4kPa左右,选择此压强的理由是
在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失
在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失
.

 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.

 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.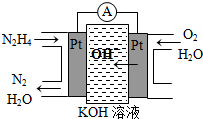 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.