
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液,②乙醇和丁醇,③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列叙述正确的是
A. 1molAlCl3在熔融状态时含有的离子总数为0.4NNA
B. 1molOH-与17gNH3所含的电子数分别为9NA和10NA
C. 常温常压下,0.1molNH3与0.1molHCl充分反应后所得的产物中含有的分子数为0.1NA
D. 13.8gNO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:

(1)发生“电解I”时,所用的交换膜是_______________(填“阳离子交换膜”或“阴离子交换膜”)。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为____________________________。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是___。

(3)“电解II”的阳极产物为______________(填离子符号)。
(4)操作a的操作名称是_______,该流程中可循环利用的物质是_____________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为at,最终制得的Cu(ClO4)2·6H2O为bt,则产率为__________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,O.OOl mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )

A. 原子半径:b
B. a、c、d形成的化台物一定是共价化合物
C. W、X、Y中X的熔沸点最高
D. Y、Z均可用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.氧化剂被还原,还原剂被氧化
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的物质,获得电子的能力一定强
D.一种元素被氧化,肯定有另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇的化学性质中,各反应的断键方式可概括如下:

关于下列化学反应类型断键部位描述正确的是
A. 发生酯化反应时断键②
B. 发生催化氧化反应时断②③键
C. 生成乙醚断时①②键
D. 与钠反应时断②键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 常温常压下,17g甲基(—14CH3)所含的中子数9NA
C. 标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为![]() NA
NA
D. 1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3: C(s)+CO2(g)2CO(g) K1
CO(g)+H2O(g)CO2(g)+H2(g) K2
C(s)+H2O(g)CO(g)+H2(g) K3
则K1、K2、K3之间的关系是K3=
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法不正确的是( )
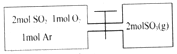
A. 第一次平衡时,SO2的物质的量左室更多
B. 入气体未反应前,左室压强和右室样大
C. 第一次平衡时,左室内压强一定小于右室
D. 第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com