
| CH3COOAg | AgCl | AgCrO4 | AgS | |
| Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
| A.等体积浓度均为0.02mol?L-1的CH3COONa和AgN03溶液混合能产生沉淀 |
| B.离浓度均为0.01mol?L-1的CrO42-和Cl-混合溶液中慢慢滴入AgN03溶液时,CrO42-先沉淀 |
| C.在CH3COOAg悬浊液中加人盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl |
| D.298K时.上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCI)>c(Ag2CrO4)>c(Ag2S) |
| Ksp(AgCl) |
| C(Cl-) |
| 1.77×10 -10 |
| 0.01 |
|
|
| 2.3×10-3 |
| 1.77×10-10 |
| 3 | 2.24×10-12 |


科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三下学期第一次模拟考试(理综)化学部分 题型:化学题
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
 2 H2O(g)
2 H2O(g)
2 H2 (g) + O2(g) △H=+484kJ· mol-1,不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20min的反应速率v(H2O)= ;达到平衡时,至少需要吸收的光能为 kJ。
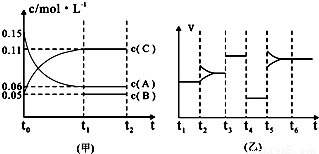
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:

Ⅰ:t4~t5阶段改变的条件是 t5~t6阶段改变的条件是
Ⅱ:B的起始浓度为 ,该反应方程式为
查看答案和解析>>
科目:高中化学 来源:2012届安徽省高二下学期期中考查化学试卷 题型:选择题
下列说法错误的是
A、已知298K时,2SO2(g)+O2(g) 2SO3(g) △H=-197kJ/ mol,对该热化学方程式理解为:在该条件下,向密闭容器中通入2摩SO2和1摩O2,达到平衡时放出热量是197 kJ
B、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C、吸热反应是指反应物所具有的总能量低于生成物所具有的总能量,而不是看反应过程是否需要加热
D、对下列反应:HCl(aq) + NaOH(aq)=NaCl(aq) + H2O(l) △H=-Q1kJ/mol
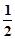 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= 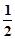 Na2SO4(aq)+H2O(l)
△H=-Q2kJ/mol
Na2SO4(aq)+H2O(l)
△H=-Q2kJ/mol
上述反应均在溶液中进行,则Q2>Q1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
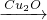 2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省宁波市高三(上)期末化学试卷(解析版) 题型:解答题
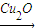 2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com