
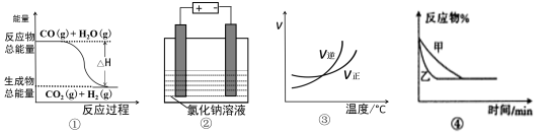
| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 | |
| B. | 图②表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体 | |
| C. | 图③表示可逆反应:A2(g)+3B2(g)?2AB3(g)△H<0 | |
| D. | 图④表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙压强大 |
分析 A.由图可知,CO(g)、H2O(g)的总能量比CO2(g)、H2(g)的总能量高;
B.惰性电极解足量的氯化钠溶液,发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
C.由图可知,交叉点后升高温度,逆反应速率大于正反应速率,可知升高温度平衡逆向移动;
D.2A(g)+B(g)?3C(g)+D(s)为反应前后体积不变的反应,则增大压强,反应速率加快,平衡不移动.
解答 解:A.图①反应物总能量大于生成物总能量,反应放热,则CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,故A正确;
B.图②电解足量氯化钠溶液,阳极生成Cl2,阴极生成H2,物质的量相同,但体积受温度、压强影响,且氯气与水反应,则阴、阳极产生气体体积不相等,故B错误;
C.图③随着温度的升高,逆反应速率大于正反应速率,平衡向逆方向进行,说明反应放热,则A2(g)+3B2(g)?2AB3(g)△H<0,故C正确;
D.图④中因乙先到达平衡,故乙的压强大,甲的压强小,但增大压强,平衡向正反应方向移动,反应物百分含量减少与图象相符,故D正确.
故选B.
点评 本题考查化学平衡的影响因素及反应热、焓变,为高频考点,把握图中能量变化、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4→H2++SO42- | B. | NH3•H2O?NH4++OH- | ||
| C. | Ca(OH)2?Ca2++2OH- | D. | NaHCO3→Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C和脱氢维生素C | B. | 维生素C和HI | ||
| C. | I2和HI | D. | I2和脱氢维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 24 | C. | 20 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用聚氯乙烯树脂生产食品包装袋 | |
| B. | 用工业酒精勾兑白酒 | |
| C. | 合理利用可燃冰有利于弥补能源短缺 | |
| D. | 用含甲酚的药皂除菌消毒,是利用酚类物质的强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气电极是负极 | |
| B. | 电子由铝合金电极经电解质溶液流向空气电极 | |
| C. | 负极的反应式为:O2+2 H2O+4 e-=4 OH- | |
| D. | 电池工作时铝合金电极不断被消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 | |
| B. | 根据溶液的pH与溶液酸碱性的关系,推出pH=7.0的溶液一定显中性 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HC1、HBr、HI的还原性依次增强 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,因此NH3沸点低于PH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com