
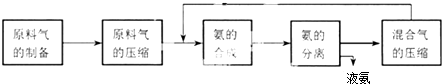
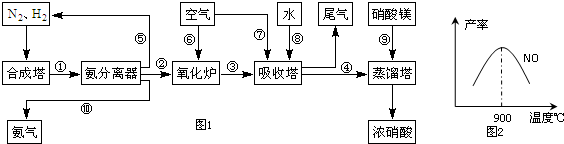
| A、混合气进行循环利用遵循绿色化学思想 |
| B、对原料气进行压缩可以增大原料气的转化率 |
| C、合成氨反应须在低温下进行 |
| D、使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |


科目:高中化学 来源: 题型:
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
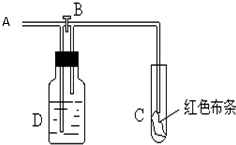 如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )| A、D中可能是浓硫酸 |
| B、通入的氯气含有水蒸气 |
| C、D中可能是水 |
| D、D中不可能是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
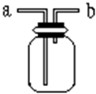 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:
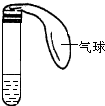 某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
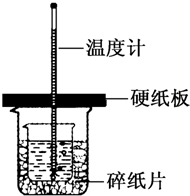 根据中和热的测定实验填空.
根据中和热的测定实验填空.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将混合气体通过氢氧化钠溶液 |
| B、将混合气体通过溴水 |
| C、将混合气体在催化剂条件下跟氢气反应 |
| D、使混合气体中的乙烯气体发生加聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com