
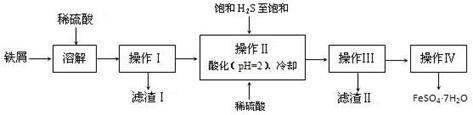


科目:高中化学 来源:不详 题型:单选题
| A.Fe2(SO4)3 | B.NaCl | C.KNO3 | D.Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.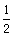 (a+b) mol (a+b) mol | B.(a-b) mol | C.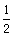 (a-b)mol (a-b)mol | D.(a+b) mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:2 | B.2:5 | C.3:2 | D.4:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ |
| B.c(Fe2+)︰c(Cu2+) = 2︰1 |
| C.c(Fe2+)︰c(Fe 3+) = 3︰1 |
| D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
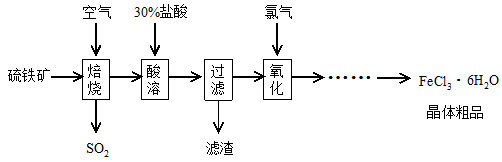
 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
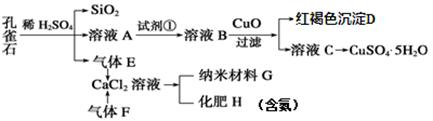

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
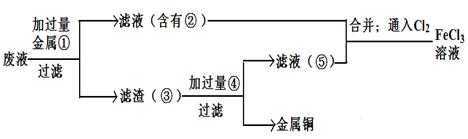
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
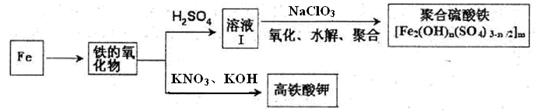
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com