
(共10分)化学上常用燃烧法确定有机物的组成.这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所列装置是用燃烧法确定有机物分子式常用的装置.

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接序号(填写接口代号)是:
________________________________________;
(2)C装置中浓H2SO4的作用是________________________________;
(3)D装置中MnO2的作用是__________________________________;
(4)燃烧管中CuO的作用是___________________________________;
(5)若准确称取 0.90 g样品(只含 C、H、O三种元素中的两种或三种),经充分燃烧后,
A管质量增加1.32 g,B管质量增加0.54 g,则该有机物所含元素的最简比为___________。
(1)g、f、e、h、i、c、d、a、b;(2)吸收水分,得干燥纯净的O2 (3)催化剂(4)使有机物充分氧化成CO2和H2O (5)CH2O
【解析】考查有机物分子式的确定。
D装置是生成氧气的,利用二氧化锰的催化作用使双氧水分解产生氧气。由于参与反应的氧气必须是纯净干燥的,所以需要对生成的氧气进行净化处理,用浓硫酸干燥氧气,然后和有机物反应。有机物的燃烧产物首先应该是用无水氯化钙来吸收生成的水,然后再用氢氧化钠吸收生成的CO2;有机物在燃烧过程中也可能燃烧不充分,从而生成CO,因此需要用氧化铜来氧化可能生成的CO;A管质量增加1.32 g,则CO2的质量是1.32g,物质的量是 。B管质量增加0.54 g,则水是0.54g,物质的量是
。B管质量增加0.54 g,则水是0.54g,物质的量是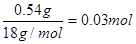 。所以有机物中氧原子的质量是0.90g-0.03mol×12g/mol-0.06mol×1g/mol=0.48mol,物质的量是0.03mol,所以C、H、O的个数之比是1︰2︰1,因此最简式是CH2O。
。所以有机物中氧原子的质量是0.90g-0.03mol×12g/mol-0.06mol×1g/mol=0.48mol,物质的量是0.03mol,所以C、H、O的个数之比是1︰2︰1,因此最简式是CH2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年福建省协作校内部模拟卷理综化学试卷(解析版) 题型:填空题
汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____== Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
|
样品序号 |
取样深度(m) |
有机质(×10—2g) |
总铬(×10—6g) |
|
样品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
|
样品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
|
样品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
|
样品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
|
样品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
|
样品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
从表中你可以得出的结论有 (答一点即可)。
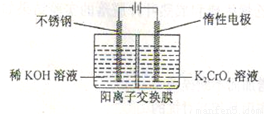
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+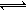 Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为
。原因是
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
(本题共8分)
水煤气法制甲醇工艺流程框图如下
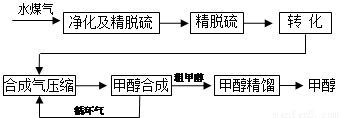
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市崇明县高三高考模拟考试(二模)化学试卷(解析版) 题型:填空题
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g)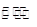 CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g)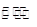 CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g)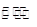 CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g)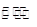 CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g)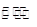 CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: (甲醇)
(甲醇) 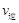 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时 (CH3OH)
(CH3OH) ;
;
该时间内的平均反应速率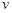 (CH3OH)
(CH3OH) ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com