
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |
分析 反应H2S+4O2F2→SF6+2HF+4O2中,S元素化合价由-2价升高到+6价,被氧化,O元素由+1价降低到0价,被还原,以此解答该题.
解答 解:A.O元素由+1价降低到0价,化合价降低,获得电子,所以氧气是还原产物,故A错误;
B.在反应中,O2F2中的O元素化合价降低,获得电子,所以该物质是氧化剂,而硫化氢中的S元素的化合价是-2价,反应后升高为+6价,所以H2S表现还原性,而O2F2表现氧化性,故B错误;
C.外界条件不明确,不能确定HF的物质的量,所以不能确定转移电子的数目,故C错误;
D.由方程式可知还原剂和氧化剂的物质的量的比是1:4,故D正确.
故选D.
点评 本题考查氧化还原反应的计算,为高频考点和常见题型,侧重于学生的分析、计算能力的考查,答题注意把握元素化合价的变化,为解答该题的关键,易错点为C,注意因条件未知,不能确定HF的物质的量,题目难度不大.


科目:高中化学 来源: 题型:解答题
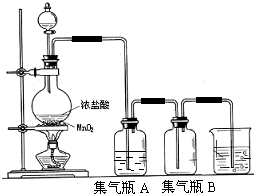
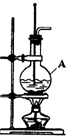 在实验室制取乙烯的装置图(如图)中,
在实验室制取乙烯的装置图(如图)中,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
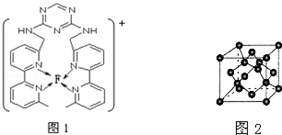
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
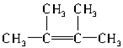 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
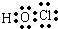 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023b2/n | B. | b2/n | C. | n/b2 | D. | 6.02×1023b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com