
����Ŀ������������У�����CuCl��������Һ���ղ������ⶨCO�ĺ������仯ѧ��Ӧ���£�2CuCl+2CO+2H2O��Cu2Cl22CO2H2O���ش��������⣺
(1)Cu��Ԫ�����ڱ�������______(ѡ����s������p������d������ds��)��Ԫ�ء�
(2)C��N��O����ԭ���еĵ�һ������������____________��NO3- ���ӵĿռ乹����______��
(3)CO��N2���Ƶȵ����塣�±�ΪCO��N2���й���Ϣ��
�������� | A-B(����) | A=B(˫��) | A��B(����) | |
����(kJ/mol) | CO | 351 | 803 | 1071 |
N2 | 159 | 418 | 946 | |
���ݱ������ݣ�˵��CO��N2���õ�ԭ����________________________��
(4)Cu2Cl22CO2H2O��һ��������ṹ��ͼ��ʾ��

�ٸ����������ԭ�ӵ��ӻ���ʽΪ_________________________��
�ڸ�������У�CO������ʱ��λԭ����C������O��ԭ����______________________��
��1molCu2Cl22CO2H2O���е�______________��������
���𰸡�ds N ƽ�������� CO�е�һ�������ļ��ܱ�N2�ĵ�һ�������ļ���С�ܶ࣬CO�ĵ�һ������������ sp3 �縺�ԣ�C��O��C�Թµ��ӶԵ����������������������µ��Ӷ� 14NA
��������
(1)CuΪ29��Ԫ�أ�λ�ڵ������ڣ��ڢ�B�壬����ds�����ʴ�Ϊ��ds��
(2) C��N��O��λ�ڵڶ�����������������һ������£�ͬ����Ԫ�ش������ң���һ����������N��2p�������������ȶ�������ʧ���ӣ���N�ĵ�һ�����ܱ�O�����ߵĵ���������ΪN��NO3��N�ļ۲���Ӷ���=![]() =3����������Nԭ���ӻ�����Ϊ��sp2�ӻ����µ��Ӷ���=0�����ԣ�NO3Ϊƽ�������Σ��ʴ�Ϊ��N��ƽ�������Σ�
=3����������Nԭ���ӻ�����Ϊ��sp2�ӻ����µ��Ӷ���=0�����ԣ�NO3Ϊƽ�������Σ��ʴ�Ϊ��N��ƽ�������Σ�
(3)CO�е�һ�������ļ��ܱ�N2�ĵ�һ�������ļ���С�ܶ࣬����CO�ĵ�һ���������ϣ�CO��N2���ã��ʴ�Ϊ��CO�е�һ�������ļ��ܱ�N2�ĵ�һ�������ļ���С�ܶ࣬CO�ĵ�һ�����������ѣ�
(4)����ԭ����Cuԭ���γ���2�������������2�Թµ��ӣ�����4���ӻ�������ӻ�����Ϊsp3���ʴ�Ϊ��sp3��
��C�ĵ縺��С��O���Թµ��Ӷ��������������������ӶԸ����ף���CO������ʱ����λԭ����C������O���ʴ�Ϊ���縺�ԣ�C��O��C�Թµ��ӶԵ����������������������µ��Ӷԣ�
���и������Ľṹ��֪��1molCu2Cl22CO2H2O����8mol��λ����4molH-O����2molCO��2mol������H-O������λ����������������1molCu2Cl22CO2H2O����8mol+4mol+2mol=14mol��������14NA���������ʴ�Ϊ��14NA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�±������������ȷ����
A.CH2Cl2�� ��
��![]() ���ֽṹ
���ֽṹ
B.����ϩֻ��һ�ֽṹ����1��2��������ϩ�����ֽṹ�����������칹��
C.�����������е���Ԫ�ؿɽ��������NaOHˮ��Һ���ȳ�ַ�Ӧ���ٵ���AgNO3��Һ���ɹ۲쵽dz��ɫ��������
D.1��������2�������ֱ���NaOH���Ҵ���Һ���ȣ�������ͬ����Ӧ���Ͳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���������о�����ͬһ��Ԫ��M������֮������ͼ��ʾ��ת����ϵ��AΪһ�ֽ������ʣ������ֱ�ӹ�ϵ������������Ӧ�٢ڢ۾�Ϊ���Ϸ�Ӧ����Ӧ��Ϊ�û���Ӧ�������й�˵���������
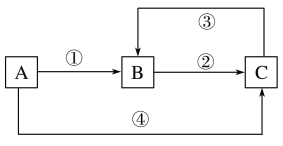
A. ���������Լ�����������
B. ������Ҫ�Ӿ��������Ե��Լ�
C. Ԫ��M�ڢ��з����ļ�̬�仯Ҳ��ͨ���ӵ⻯����Һʵ��
D. A��ϡ���ᷴӦһ����ʵ��Ԫ��M�ڢ��з����ļ�̬�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KIO3��һ����Ҫ�������������Ϊʳ���еIJ�������ش��������⣺
��1��KIO3�Ļ�ѧ������_______��
��2��������KClO3���������Ʊ�KIO3������������ͼ��ʾ��
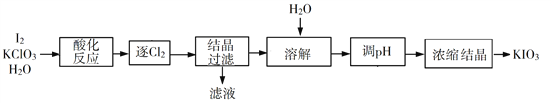
���ữ��Ӧ�����ò�����KH(IO3)2��Cl2��KCl������Cl2�����õķ�����________������Һ���е�������Ҫ��_______������pH���з�����Ӧ�Ļ�ѧ����ʽΪ__________��
��3��KIO3Ҳ�ɲ�������ⷨ���Ʊ���װ����ͼ��ʾ��
��д�����ʱ�����ĵ缫��Ӧʽ______��
����������ͨ�������ӽ���Ĥ��������ҪΪ_________����Ǩ�Ʒ�����_____________��
��������ⷨ����ȣ���KClO3������������Ҫ����֮����______________��д��һ�㣩��
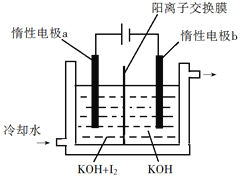
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǻ�ˮ������ɵ���ˮ������ˮ����ʱ���������������ߵ��η���±֭����ʽ����Χ�ڱ���֮�䣬�γ���������![]() �����η���һ��NaCl��
�����η���һ��NaCl��![]() ������½ṹ����ͼ��ʾ���������ı���ﵽ1�����ϣ��ڻ����ˮΪ��ˮ������������ȷ����( )
������½ṹ����ͼ��ʾ���������ı���ﵽ1�����ϣ��ڻ����ˮΪ��ˮ������������ȷ����( )
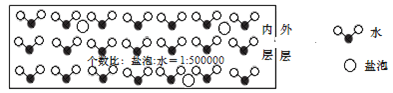
A.�����ڲ���������Խ�࣬�ܶ�ԽС
B.��������Խ�����ڲ����������Խ��
C.�����ڲ����������ڵ��η���Ҫ��NaCl���ӵ���ʽ����
D.�����ڲ�NaCl��Ũ��ԼΪ![]() ������ܶ�Ϊ
������ܶ�Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼA��ʾ��ת����ϵ�У����巴Ӧ�����ԣ���a��b��c��d�ֱ�Ϊ���ֶ�����Ԫ�صij������ʣ������Ϊ���ǵĻ����i����ҺΪ�������ᣬa��һ��ͬ��������ľ�����ͼB��ʾ��
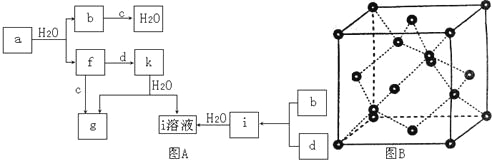
�ش��������⣺
��1��ͼB��Ӧ������������_________���侧���е�ԭ����Ϊ______����������Ϊ_______��
��2��d��Ԫ�ص�ԭ�Ӻ�������Ų�ʽΪ_______��
��3��ͼA���ɶ���Ԫ����ɵ������У��е���ߵ���______��ԭ����______�������ʵķ��ӹ���Ϊ_________������ԭ�ӵ��ӻ��������Ϊ_________��
��4��ͼA�е�˫ԭ�ӷ����У��������ķ�����_________��
��5��k�ķ���ʽΪ_________������ԭ�ӵ��ӻ��������Ϊ_________������_________���ӣ����������������Ǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2O�ǻ���ɫ����ǿ�Ҵ̼�����ζ�����壬��һ��ǿ��������������ˮ�һ���ˮ��Ӧ���ɴ����ᣬ���л����ԭ���Ӵ������ʱ�ᷢ��ȼ�ղ���ը����ȡCl2O��װ����ͼ��ʾ��
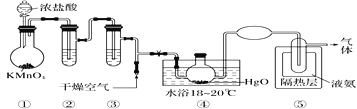
��֪��Cl2O���۵�Ϊ��116 �棬�е�Ϊ3.8 �棬Cl2O�ڿ����еİٷֺ����ﵽ25�������ױ�ը��Cl2�ķе�Ϊ��34.6 �棻HgO��2Cl2==HgCl2��Cl2O������˵���в���ȷ����
A.װ�âڢ���ʢװ���Լ������DZ���ʳ��ˮ��Ũ����
B.ͨ����������Ŀ���ǽ����ɵ�Cl2Oϡ�ͣ���С��ըΣ��
C.��װ�â����ݳ��������Ҫ�ɷ���Cl2O
D.װ�â����֮�䲻�������ӣ���Ϊ�˷�ֹ��ȼ�պͱ�ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������װ������ԭ��ص���________��
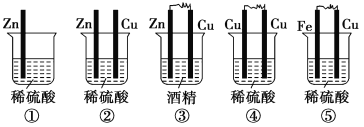
��2����ѡ����ԭ����У�________�Ǹ���������________��Ӧ��________���������ü���������______________________________��
��3����ԭ��ط�Ӧ�Ļ�ѧ����ʽΪ_____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4�����������Ҫ�ɷ�Ϊ���������������Ͷ������裬��ҵ�Ͼ������й��տ���ұ����������

����˵���д������(����)
A. �٢��г����Լ���������Ҫ���й��˲���
B. a��b����Ԫ�صĻ��ϼ���ͬ
C. ������Ҫͨ������İ���
D. �����еIJ����Ǽ���������dһ����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com