

分析 (1)根据v=$\frac{△V}{△t}$分析;
(2)由外界条件对化学反应速率的影响分析;
(3)盐酸和稀硫酸具有相同的阳离子H+,稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,可能为阴离子的影响.
解答 解:(1)由v=$\frac{△V}{△t}$知,反应速率与气体的体积和时间有关,所以一种是固定体积比较时间,另一种是固定时间比较体积,
故答案为:相同时间内产生气体体积大小;
(2)该反应是一个放热的反应,随着反应的进行,放出的热量越多,溶液的温度越高,温度越高反应速率越大;随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小,
故答案为:放热;盐酸浓度不断减小;
(3)盐酸和稀硫酸具有相同的阳离子H+,稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,可能为Cl-会促进该反应的进行,(或SO42-抑制该反应的进行),
故答案为:Cl-会促进该反应的进行,(或SO42-抑制该反应的进行).
点评 本题考查了化学反应速率的影响因素,外界条件影响化学反应速率,注意决定化学反应速率的是物质本身的性质,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
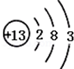 根据如图的原子结构示意图回答下列问题.
根据如图的原子结构示意图回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气可用排水法收集 | |
| B. | 氯化铵固体加热容易分解 | |
| C. | 氨气和酸相遇都能产生白烟 | |
| D. | 实验室用氢氧化钠溶液和氯化铵溶液加热制NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应为NO+NO2+O2+H2O═2HNO3 | |
| B. | 总反应为2NO+10NO2+4O2+6H2O═12HNO3 | |
| C. | 生成硝酸的物质的量浓度接近0.03 mol/L | |
| D. | 生成硝酸的物质的量浓度约为0.045 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
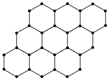 2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )
2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )| A. | 石墨烯可导电,说明它是电解质 | |
| B. | 石墨烯、金刚石、C60都是碳的单质 | |
| C. | 金刚石与石墨烯互为同位素 | |
| D. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C为不同的核素,有不同的化学性质 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:填空题
医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:
(1)配平该反应的离子方程式,并在 中填上所需的微粒。
中填上所需的微粒。
H++ MnO4- + H2C2O4= CO2↑+ Mn2++ 
(2)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为 mol。
(3)测定血钙的含量的方法:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 ____________________。
②溶解沉淀时 (“能”或“不能”)用稀盐酸,原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com