

| ʱ��/min | CH4��mol�� | H20�� mol�� | CO ��mol�� | H2 ��mol�� |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
| ||
| ���¸�ѹ |
| ||
| ���¸�ѹ |
| ||
| ���¸�ѹ |
| 2x |
| 2x+1-x+4-3x |
| 0.33��3 |
| 4 |
| ||
| ���¸�ѹ |
| ��c |
| ��t |
| ||
| 5min |


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ���¸�ѹ |
| ||
| ���¸�ѹ |
 CO��g��+3H2��g������H=+QkJ/mol��Q��0��
CO��g��+3H2��g������H=+QkJ/mol��Q��0��| ʱ��/min | CH4��mol�� | H20�� mol�� | CO ��mol�� | H2 ��mol�� |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ʱ��/min | CH4��mol�� | H2O��mol�� | CO��mol�� | H2��mol�� |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2NH3��g������H=-92.4kJ/mol
2NH3��g������H=-92.4kJ/mol 2NH3��g������H=-92.4kJ/mol
2NH3��g������H=-92.4kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013���㽭ʡ�����и�����ѧ��������У������ѧ�Ծ����������� ���ͣ������
(14��)�ϳɰ��Ի�ѧ��ҵ������ҵ������Ҫ���塣
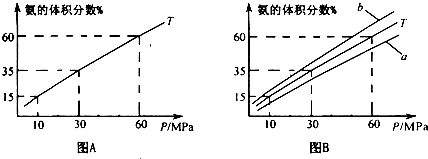
(1)��ϳ����а����ʵ���֮��l��4����N2��H2���а��ĺϳɣ�ͼAΪT��ʱƽ�������а��������������ѹǿ(p)�Ĺ�ϵͼ��
��ͼA�а������������Ϊ15��ʱ��H2��ת����Ϊ ��
��ͼB��T=450�棬���¶�Ϊ500��ʱ��Ӧ�������� (�a����b��)��
(2)�ϳɰ�������������ɼ�����ˮ��Ӧ�Ƶã���Ӧ���Ȼ�ѧ����ʽΪ
CH4(g)+H2O(g)  CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���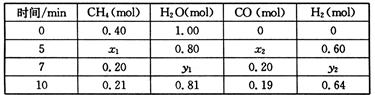
�ٷ����������ݣ��ж�5 minʱ��Ӧ�Ƿ���ƽ��״̬? (��ǡ���)��ǰ5 min��Ӧ��ƽ����Ӧ����v(CH4)= ��
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��K= ��
�۷�Ӧ��7~10 min�ڣ�CO�����ʵ������ٵ�ԭ������� (����ĸ)��
a������CH4�����ʵ��� b�������¶� c�������¶� d������H2
������7����ʱ������ѹ����1L��������������ϵ�л����ӵ�7���ӵ���11���ӽ�����ƽ��ʱ����Ũ����ʱ��ı仯���ߡ�
a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ�����и�����ѧ��������У������ѧ�Ծ��������棩 ���ͣ������
(14��)�ϳɰ��Ի�ѧ��ҵ������ҵ������Ҫ���塣
(1)��ϳ����а����ʵ���֮��l��4����N2��H2���а��ĺϳɣ�ͼAΪT��ʱƽ�������а��������������ѹǿ(p)�Ĺ�ϵͼ��
��ͼA�а������������Ϊ15��ʱ��H2��ת����Ϊ ��
��ͼB��T=450�棬���¶�Ϊ500��ʱ��Ӧ�������� (�a����b��)��
(2)�ϳɰ�������������ɼ�����ˮ��Ӧ�Ƶã���Ӧ���Ȼ�ѧ����ʽΪ
CH4(g)+H2O(g)  CO(g)+3H2(g)
��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
CO(g)+3H2(g)
��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
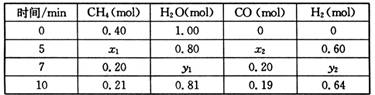
�ٷ����������ݣ��ж�5 minʱ��Ӧ�Ƿ���ƽ��״̬? (��ǡ���)��ǰ5 min��Ӧ��ƽ����Ӧ����v(CH4)= ��
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��K= ��
�۷�Ӧ��7~10 min�ڣ�CO�����ʵ������ٵ�ԭ������� (����ĸ)��
a������CH4�����ʵ��� b�������¶� c�������¶� d������H2
������7����ʱ������ѹ����1L��������������ϵ�л����ӵ�7���ӵ���11���ӽ�����ƽ��ʱ����Ũ����ʱ��ı仯���ߡ�
a
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com