
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
|
| A. |
FeCl3+3KSCN⇌Fe(SCN)3+KCl(忽略液体体积变化) |
|
| B. |
2NO+O2⇌2NO2△H<0 |
|
| C. |
NO(g)+CO(g)⇌ |
|
| D. |
A2(g)+3B2(g)⇌2AB3(g)△H=﹣373.4KJ•mol﹣1 |
考点:
化学平衡的影响因素.
专题:
图示题;化学平衡专题.
分析:
A、FeCl3+3KSCN⇌Fe(SCN)3+KCl,离子方程式为Fe3++3SCN﹣=Fe(SCN)3,KCl对平衡无影响;
B、2NO+O2⇌2NO2△H<0,反应是放热反应,升温平衡逆向进行;
C、反应是放热反应,升温平衡逆向进行,平衡常数减小;
D、根据“定一议二”分析,反应是放热反应,温度升高平衡逆向进行;
解答:
解:A、FeCl3+3KSCN⇌Fe(SCN)3+KCl,离子方程式为Fe3++3SCN﹣=Fe(SCN)3,KCl对平衡无影响,加入氯化钾忽略液体体积变化,铁离子浓度不变,故A错误;
B、2NO+O2⇌2NO2△H<0,反应是放热反应,升温平衡逆向进行,一氧化氮转化率减小,B点为正向进行,正反应速率大于逆反应速率,故B错误;
C、反应是放热反应,升温平衡逆向进行,平衡常数减小,图象符合,故C正确;
D、根据“定一议二”分析,反应是放热反应,温度升高平衡逆向进行,AB3含量减小,增大压强平衡正向进行,AB3含量增大,图象符合,故D正确;
故选CD.
点评:
本题考查了化学平衡影响因素分析判断,图象分析方法,平衡移动原理是解题关键,题目较简单.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列关于燃烧热的说法中正确的是()
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105Pa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是()
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是强电解质或弱电解质的是( )
|
| A. | 某物质熔化时不导电,则该物质为弱电解质 |
|
| B. | 某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
|
| C. | 某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
|
| D. | 溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 ;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=﹣247.4kJ•mol﹣1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=﹣2986kJ•mol﹣1
4P(s,红磷)+5O2=P4O10(s);△H=﹣2956kJ•mol﹣1
则白磷比红磷 (填“稳定”或“不稳定”)
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S= 0,△H 0 (填“<”、“>”、“=”)
(5)如图为电解精炼银的示意图, a (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 .
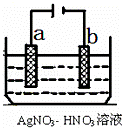
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体摩尔体积的描述中正确的是( )
-A.-相同条件下,气体物质的量越大,气体摩尔体积越大
-B.-通常状况下的气体摩尔体积大于22.4L/mol
-C.-非标准状况下的气体摩尔体积不可能为22.4L/mol
-D.-在标准状况下,混合气体的气体摩尔体积比22.4L/mol大
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)147gH2SO4中含 mol原子,与 g CO2所含有的氧原子数相同.
标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为 .
(3)在标准状况下,V L氨气溶于1L水中,所得溶液的密度为ρg•cm﹣3,溶液的质量分数为ω.则此溶液的物质的量浓度为: 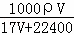 或
或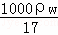 mol/L
mol/L
(4)将Wg胆矾(CuSO4 •5H2O )溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,则溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 标准状况下任何气体的摩尔体积都是22.4 L |
|
| B. | 1mol气体的体积若是22.4 L,它必定处于标准状况 |
|
| C. | 两种气体的物质的量之比等于其原子个数比 |
|
| D. | 标准状况下,1mol H2和O2的混合气体的体积是22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com