
| A. | 283:503 | B. | 55:141 | C. | 141:196 | D. | 1:1 |
分析 碳不完全燃烧损失的热量为生成的一氧化碳燃烧放出的热量.根据碳原子守恒计算出一氧化碳的物质的量,再根据一氧化碳燃烧的热化学方程式计算.
解答 解:50g碳的物质的量为:$\frac{50g}{12g/mol}$=$\frac{25}{6}$mol,得到等体积的CO和CO2,CO、CO2的物质的量为:$\frac{25}{6}$mol×$\frac{1}{2}$=$\frac{25}{12}$mol,
根据CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.57kJ•mol-1可知,$\frac{25}{12}$molCO燃烧放出的热量为:282.57kJ/mol×$\frac{25}{12}$mol=588.69kJ,则50g碳不完全燃烧生成 $\frac{25}{12}$molCO损失的热量为588.69kJ;
根据C(s)+$\frac{1}{2}{O}_{2}$(g)═CO(g)△H=-110.35kJ•mol-1,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.57kJ•mol-1可知,C(s)+O2(g)═CO2(g)△H=-392.92kJ•mol-1,$\frac{25}{12}$molC完全燃烧生成二氧化碳放出的热量为:$\frac{25}{12}$mol×392.92kJ•mol-1=818.58kJ;
$\frac{25}{12}$molC完全燃烧生成CO放出的热量为:$\frac{25}{12}$mol×110.35kJ•mol-1=229.90kJ,
则50g碳燃烧放出总容量为:229.90kJ+818.58kJ=1048.48kJ,
损失的能量与实际放出的能量之比为:588.69kJ:1048.48kJ≈0.56,
A.283:503≈0.56,故A正确;
B.55:141≈0.39,故B错误;
C.141:196≈0.71,故C错误;
D.1::11,故D错误;
故选A.
点评 本题考查反应热的计算,题目难度中等,正确计算碳燃烧损失热量为解答关键,注意掌握盖斯定律在热化学方程式计算中的应用,试题培养了学生的化学计算能力.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:推断题
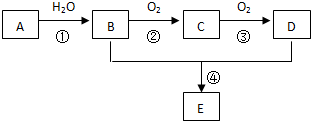
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
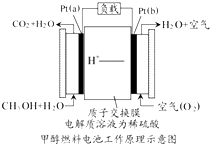 科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下:
科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
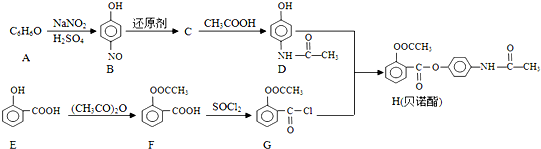
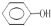 ;E中含氧官能团的名称为羟基、羧基.
;E中含氧官能团的名称为羟基、羧基.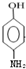 .
.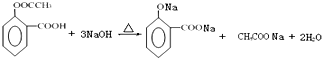 .
.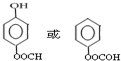 .
.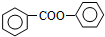 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):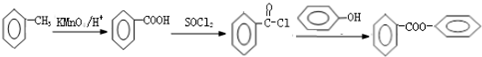 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液1加入KSCN溶液一定呈红色 | |
| B. | 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl | |
| C. | 固体1与稀盐酸反应时还生成了标准状况下气体1.12L | |
| D. | 沉淀2不溶于任何酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有(1) | B. | 只有(3) | C. | (1)(2)(3)的混合物 | D. | (1)(2)(3)(4)的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com