
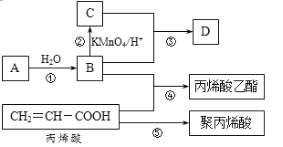
【题目】A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
(1)B的结构简式为______________,C中官能团的名称为__________。
(2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。(多选)
A.加成反应 B.取代反应 C.中和反应 D.氧化反应
(3)用一种方法鉴别B和C,所用试剂是___________________。
(4)丙烯酸乙酯的结构简式为_______________。
(5)写出下列反应方程式和有机反应基本类型:
③___________________________,___________反应;
⑤___________________________,___________ 反应。
【答案】CH3CH2OH羧基ABCDNa2CO3或NaHCO3溶液或紫色石蕊试液(答案合理均给分)CH2=CHCOOCH2CH3CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O酯化/取代nCH2=CH-COOH
CH3COOC2H5+H2O酯化/取代nCH2=CH-COOH![]()
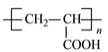 加聚
加聚
【解析】
A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,乙烯与水发生加成反应生成B是乙醇,乙醇发生氧化反应生成C是乙酸,B与C在浓硫酸和加热条件下发生反应,生成的有机物D有特殊香味,是乙酸乙酯;乙醇和丙烯酸发生酯化反应生成丙烯酸乙酯,丙烯酸发生加聚反应生成聚丙烯酸,据此解答。
根据以上分析可知A是CH2=CH2,B是CH3CH2OH,C是CH3COOH,D为CH3COOCH2CH3。则
(1)B是乙醇,结构简式为CH3CH2OH,C是CH3COOH,C中官能团的名称为羧基。
(2)A.丙烯酸含有碳碳双键,能发生加成反应,A正确;B.丙烯酸含有羧基,能发生取代反应,B正确;C.丙烯酸含有羧基,能发生中和反应,C正确;D.丙烯酸含有碳碳双键,能发生氧化反应,D正确。答案选ABCD;
(3)乙醇含有羟基,乙酸含有羧基,显酸性,因此鉴别B和C的所用试剂是Na2CO3或NaHCO3溶液或紫色石蕊试液。
(4)丙烯酸乙酯的结构简式为CH2=CHCOOCH2CH3。
(5)反应③是乙醇和乙酸的酯化反应,方程式为CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O;反应⑤是丙烯酸发生加聚反应生成聚丙烯酸,方程式为nCH2=CH-COOH
CH3COOC2H5+H2O;反应⑤是丙烯酸发生加聚反应生成聚丙烯酸,方程式为nCH2=CH-COOH![]()
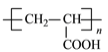 。
。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
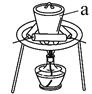
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
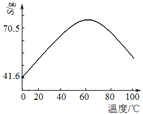
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
A.都能使品红试液褪色
B.都能和氢氧化钠溶液反应生成盐和水
C.都有刺激性气味
D.常温下都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
【答案】C
【解析】选项A的平衡应该标注各物质的状态,即为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O
Ba2+(aq)+SO42-(aq),选项A错误。选项B的电荷不守恒,应该为A13++3A1O2-+6H2O![]() 4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-
4Al(OH)3↓,选项B错误。将选项C的方程式两边各去掉一个水分子,即得到:HCO3-![]() CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
CO32-+H+,表示的是碳酸氢根的电离,选项C正确。亚硫酸根离子的水解应该分步进行,选项D错误。
【题型】单选题
【结束】
17
【题目】下列生活中的化学现象解释不正确的是
A. 生石灰可作食品速热剂是利用原电池原理
B. 泡沫灭火器是运用双水解原理产生CO2
C. 铝盐可作净水剂是利用铝离子水解产生胶体
D. 将煤气中毒的人移到通风处,是运用平衡理论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:"用水银一两,白矾[KAl(SO4)2]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
(1)甘汞(Hg2Cl2)中化学键类型主要为___________.
(2)[KAl(SO4)2]所属物质类别为__________ (填标号)
A.酸式盐 B.复盐 C.正盐 D.混盐 E.硫酸盐
(3)文中“同研”涉及的操作,若在实验室通风橱内完成,则所需的仪器是_______。
(4)文中“则粉升于盆上矣”涉及的混合物分离方法是__________
(5)甘汞(Hg2Cl2)制备反应中,氧化剂与还原剂的物质的量之比为_________,该反应中还原产物是__________。
(6)已知文中一两等于十钱,则甘汞的产率约为________(保留三位有效数字)。
(7)由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与无水乙醇反应时增大无水乙醇的用量
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将炭块磨成炭粉用于燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝锰合金可作炼钢脱氧剂。某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:取20.00mL 0.015mol/L K2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2mL.
Ⅱ过硫酸铵[(NH4)2S2O8]催化氧化滴定法测定锰含量
取mg铝锰合金于锥形瓶中,加入适量的浓磷酸,加热至完全溶解,稀释冷却谣匀,再加入少量的硝酸银溶液、过量的过硫酸铵溶液,加热煮沸至无大量气泡冒出,冷却至室温(此时溶液中锰的化合价为+7),用标定的硫酸亚铁铵溶液进行滴定,根据实验数据计算铝锰合金中锰的含量。
[查阅资料]①酸性条件下,Cr2O72-具有很强的氧化性,易被还原为绿色的Cr3+;
②R溶液的变色原理: ![]()
(1)Ⅰ中步骤1.2需要的玻璃仪器有锥形瓶、胶头滴管,_______、________。
(2)Ⅰ中滴定过程,主要反应的离子方程式是________。
(3)Ⅰ中步骤2的主要作用是_________
(4)Ⅱ中硫酸亚铁铵溶液的滴定浓度是_________mol/L (用含V1、V2的代数式表示)。
(5)Ⅱ中加入硝酸银溶液的目的是________。
(6)Ⅱ中若未加热煮沸无大量气泡冒出,锰含量测定结果将_______(填“偏大”“偏小”或“无影响”)。
(7)为了提高该实验的准确度和可靠度,需进行________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如下,其总反应为 2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是( )

A. 电极 A 是负极,物质 a 为甲醇
B. 电池工作时,电解液中的 H+通过质子交换膜向 B 电极迁移
C. 放电前后电解质溶液的 pH 增大
D. b 物质在电极上发生的电极反应式为: O2+4eˉ+2H2O=4OHˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院官微曾给出灰霾中细颗粒物的成因,部分分析如下图所示。
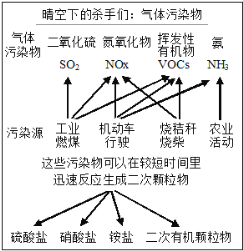

(1)根据如图信息可以看出,所列的气体污染物并非由机动车行驶造成的是______。汽车发动机废气稀燃控制系统主要工作原理如上右图所示;写出稀燃过程中NO发生的主要反应的方程式_____________________________________。
(2)农业活动排出的氨可能是施用的化肥分解,也可能是施用不当导致的。比如某些氮肥与碱性肥料混合施用会释出氨,用离子方程式解释________________________。
(3)经过研究发现我国的霾呈中性,其主要原因如下图所示,A的化学式是________。
2NH3(气)+SO2(气)+2NO2(气)![]() 2NH4+(溶液)+A(溶液)+2HONO(气)
2NH4+(溶液)+A(溶液)+2HONO(气)
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他极微量离子忽略不计):
离子 | Na+ | SO42- | NO3- | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.8×104 | 3.5×103 |
①NO和NaClO2溶液反应的离子方程式是___________________。
②表中y=_______。
(5)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式___________________________________。若用氮气制氨的产率为90%,用氨生产硝酸时氨的催化氧化和氮氧化物转化为硝酸的损耗依次为5%、3%,1000 mol氮气可制___________mol硝酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com