
| A、两者质量相等时,其分子数相等 |
| B、两者质量相等时,其原子数相等 |
| C、同温同压时,两者密度之比为1:2 |
| D、同温同压时,同体积气体所含原子数相等 |
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
| m |
| M |
| N |
| NA |
| m |
| M |
| N |
| NA |
| m |
| 32 |
| m |
| 64 |
| m |
| V |
| M |
| Vm |


科目:高中化学 来源: 题型:
| A、0.012kg12C中含有约6.02×1023个碳原子 |
| B、1molH2O中含有2 mol氢和1mol氧 |
| C、氢氧化钠的摩尔质量是40g |
| D、2mol水的摩尔质量是1mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氢氧化钠固体放在天平托盘的滤纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| B、将准确量取的18.4mol?L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| C、仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 |
| D、欲配制1000mL 0.1mol?L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )
如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )| A、该反应的化学方程式可表达为2M+N?2P |
| B、在反应时间为20min-25min之内,物质M的反应速率为0.002mol/(L?min) |
| C、当反应时间为20min时,曲线开始发生变化的原理可能是由于增大压强引起的 |
| D、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的(其它条件不变),则该反应的正反应一定为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

查看答案和解析>>
科目:高中化学 来源: 题型:
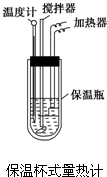 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应一定是氧化还原反应 |
| B、分解反应一定不是氧化还原反应 |
| C、置换反应一定是氧化还原反应 |
| D、复分解反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
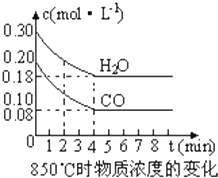 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com