
����Ŀ����֪98%��Ũ�����ܶ�Ϊ1.84g/cm3��
��1������������ʵ���Ũ��Ϊmol��L��1��
��2�����ø�Ũ�ȵ���������500 mL 0.1 mol��L��1����ʱ�����Ũ�ȵ���������ΪmL���õ��IJ�����������Ͳ���ձ�������������
�����в�����ʹ��������Ũ��ƫ�ߵ�����
A��δϴ���ձ��Ͳ����� B������ʱ����ˮ�����̶��ߺ��������ಿ��
C������ʱ�����ӿ̶��� D������ƿϴ����δ����
��3��ȡϡ�ͺ������������������п����Ӧ�����ɱ�״����11.2 L H2 �� ��Ӧ��ת�Ƶĵ�����Ϊ����
���𰸡�
��1��18.4
��2��2.7,500 mL����ƿ,��ͷ�ι�,C
��3��NA ��6.02��1023��
����������1��c =(1000�Ѧ�)/M= ![]() molL-1=18.4 molL-1��
molL-1=18.4 molL-1��
��2���ٸ���ϡ�Ͷ��ɣ�c1V1=c2V2�ã�18.4 molL-1��V mL��10-3LmL-1=0.1molL-1��500 mL��10-3LmL-1�����V��2.7����Ũ��������500 mL 0.1 molL-1�����õ��IJ�������������Ͳ���ձ����������⣬����500 mL����ƿ�Ͷ����õĽ�ͷ�ιܡ��ڸ���c=n/V��������ʱ��Ҫ���������n��V�ı仯��A�δϴ���ձ��Ͳ�������ʹnƫС����cƫ�ͣ�B�����ʱ����ˮ�����̶��ߣ���ʹVƫ����cƫ�ͣ���ʹ�������ಿ�֣�Ҳ����ı�Ũ��ƫ�͵���ʵ(��Ϊ����������Һ)��C�����ʱ���ӿ̶��ߣ���ʹVƫС����cƫ�ߣ�D�����ƿϴ����δ���ﲻӰ��ʵ���������ϣ�ѡC��
��3����״����11.2LH2�����ʵ����ǣ�11.2L��22.4Lmol-1=0.5mol�����ݷ�Ӧ��ѧ����ʽ��Zn+H2SO4=ZnSO4+H2����HԪ�ػ��ϼ���0��Ϊ+1��������1molH2��ת��2mol���ӣ���������0.5molH2��ת��1mol���ӣ������ɱ�״����11.2LH2ת�Ƶ�����ΪNA��6.02��1023����
�����㾫����������Ĺؼ������������ʵ���Ũ�ȵĸ�������֪ʶ�������Ե�λ�������������B�����ʵ�������ʾ��Һ��ɵ�����������������B�����ʵ���Ũ�ȣ�����CB=nB(mol)��V(L) ��nB������B�����ʵ�����V����Һ���������λ��mol��L��1���Լ�������һ�����ʵ���Ũ�ȵ���Һ�����⣬�˽��������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶��ߣ�


 �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯����������������ռ�м�����Ҫ�ĵ�λ�����Ͻ������仯��������֪ʶ�ش��������⣮
��1����̼����0.03%��2%֮��ij�Ͻ���Ŀǰʹ�������ĺϽ����ֺϽ��� ��
A.���Ͻ�
B.��ͭ
C.þ�Ͻ�
D.��
��2��FeCl3��Һ���ڸ�ʴͭ��ӡˢ��·�壬��Ӧ�����ӷ���ʽΪ ��
��3��ij��Һ����Mg2+��Fe2+��Al3+��Cu2+�����ӣ������м��������Na2O2���ˣ�������Ͷ�������������У�������Һ��ԭ��Һ��ȣ���Һ�д������ٵ���������������ĸ��
A.Mg2+
B.Fe2+
C.Al3+
D.Cu2+
��4��4Fe��NO3��2�ĸߴ��Ƚᾧ����һ����ɫ�����Թ��壬�ʺ����ƴ�������������ĩ����ҵ���÷���м����Fe��Fe2O3����������Ӧ�����ʣ���ȡFe��NO3��2����ķ�����ͼ��  �ٵ�1����Ӧ���¶ȹ��ߣ�����������ֽ⣬Ũ�������ȷֽ�Ļ�ѧ����ʽΪ ��
�ٵ�1����Ӧ���¶ȹ��ߣ�����������ֽ⣬Ũ�������ȷֽ�Ļ�ѧ����ʽΪ ��
�ڴ����������Ļ�ѧʽΪ �� ��д��Fe2O3�����ᷴӦ�����ӷ���ʽ ��
�۲���1������Ϊ �� ����2�IJ���Ϊ�� �� ���ˣ�ϴ�ӣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ɸ�������ɺ����ʽ��з���
��1����ͼ��ʾ�����ʷ������������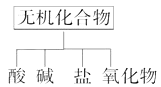
��2����Na��K��H��O��C��S��N�������ֻ�����Ԫ����ɺ��ʵ����ʣ��ֱ������±��ڢۢĺ��档
������� | �� | �� | �� | ������ |
��ѧ | ��HCl | �� | ��Na2CO3 | ��CO2 |
��3��д����ת��Ϊ�ݵĻ�ѧ����ʽ��
��4��ʵ�����Ʊ��߳�������Ӧ�����������ķ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���pH=11��ij��Һ�У���ˮ�����c��OH����Ϊ�� ��
��1.0��10��7 molL��1 ��1.0��10��6 molL��1
��1.0��10��3 molL��1 ��1.0��10��11 molL��1 ��
A.��
B.��
C.�ٻ��
D.�ۻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ���ʵ�����Na2O2��Na2O�ıȽ��У�����ȷ����
A��������������ԭ�Ӹ���֮��Ϊ4��3
B������������������ˮ��Ӧ��������Һ�������ȣ���Һ��Ũ�Ȳ����
C������������������CO2��Ӧ�����������������Ϊ1��1
D�����������������ӵ����ʵ���֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ������������������ϩ���ֿ���������ȥ�����л��е�������ϩ�ķ�����( )
A. �������ͨ��ʢˮ��ϴ��ƿB. ����������H2���
C. �������ͨ��װ�й�����ˮ��ϴ��ƿD. �������ͨ������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��Q��W��R���ֶ�����Ԫ��ԭ���������������������X��Z��Q����Ԫ����ɣ�������0.1mol/L����Һ��pH=13����ҵ�ϳ��õ�ⱥ��QR��Һ���ɼף�����������X��R����Ԫ����ɣ���ش��������⣺
��1��Q��ԭ�ӽṹʾ��ͼΪ ��
��2��YԪ�صĵ����ܷ�����ͼ��ʾ��ת������YԪ��Ϊ����Ԫ�ط��ű�ʾ�����ڼ���Һ��ͨ������YZ2���壬������Һ�ʼ��ԣ�ԭ�����������ӷ���ʽ�ͱ�Ҫ������˵������
��3��W�ĵ��ʼ��������Һ��Ӧ������������Һ��Ӧ�� �ٳ����£���W�ĵ��ʺͼ���Һ��ϣ�������Ӧ�����ӷ���ʽΪ�� ��
��Q��W����Ԫ�ؽ����Ե�ǿ��ΪQW�������������������
���б�����֤����һ��ʵ���� ��
a��Q�ĵ��ʵ��۵��W���ʵ�
b��Q������������ˮ����ļ��Ա�W������������ˮ����ļ���ǿ
c��W��ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A����ɫ��ӦΪ��ɫ��˵���������п϶�������Ԫ��
B��ij���ʵ���ɫ��Ӧ������ɫ(δ����ɫ�ܲ���)��˵���������п϶�û�м�Ԫ��
C����ɫ��Ӧ�����������ʵļ���
D����ɫ��Ӧ�ǻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������͡����ͺͻ����͵�������ȷ����
A.��������֬B.���̶��ķе�
C.���ܸ���ˮ����D.ֻ�л�������������������Һ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com