
分析 氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,据此分析.
解答 解:25℃时0.1mol•L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,R形成的酸为二元酸,所以该溶质为二元酸的酸式盐,即NaHR;
故答案为:NaHR.
点评 本题考查了弱电解质在溶液中的电离平衡,侧重于学生的分析能力和计算能力的考查,注意把握溶液中的电荷守恒以及物料守恒,题目难度不大.


科目:高中化学 来源: 题型:填空题
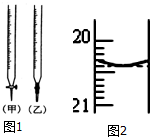 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
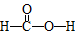 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: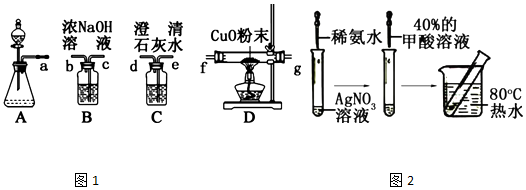
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
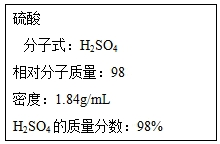 根据要求回答下列问题:
根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
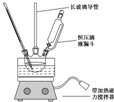 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+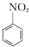 +H2O
+H2O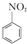 +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
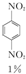
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$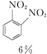 +
+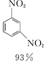 +
+
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com