
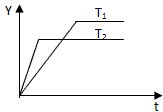
 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )| A、N2的转化率 |
| B、混合气体的平均摩尔质量 |
| C、容器的体积 |
| D、混合气体的密度 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
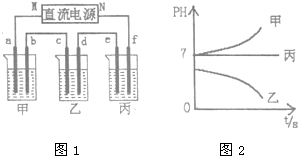 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
A、该反应的平衡常数为:K=
| ||
| B、CO和H2O的转化率相同 | ||
| C、2min内,用H2表示的反应速率为:v(H2)=0.lmol/(L?min) | ||
| D、升高温度时,V正减小,v逆增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、△H>0,m+n>x |
| B、△H<0,m+n>x |
| C、△H>0,m+n<x |
| D、△H<0,m+n<x |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:2 | B、7:1 |
| C、5 | D、8:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③④ |
| C、②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
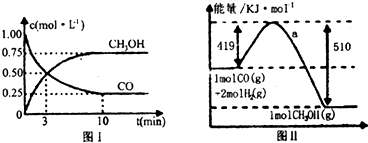
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时s能级上的电子总数是p能级上电子总数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子,W的外围电子构型是3d104s1.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时s能级上的电子总数是p能级上电子总数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子,W的外围电子构型是3d104s1.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com