
| A. | 无机含氧酸分子中的氧原子数越多,则其酸性也越强 | |
| B. | 氯化银能溶于过量的氨水.是因为它与氨水反应生成了一种可溶性的配位化合物 | |
| C. | 分子是否具有极性决定分子中是否存在极性共价键 | |
| D. | 氢键就是一种存在于某些特殊含氢元素的分子中的一种化学键 |
分析 A.比较含氧酸的强弱,应根据非羟基原子数的多少判断;
B.银离子可与氨水发生络合反应;
C.分子的极性取决于结构的对称性以及正负电荷是否重叠;
D.氢键属于分子间作用力.
解答 解:A.含氧酸分子中的非羟基氧原子数与酸性强弱成相关性,设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸的酸性越强,故A错误;
B.银离子可与氨水发生络合反应,生成可溶于水的银氨络离子,故B正确;
C.分子的极性取决于结构的对称性以及正负电荷是否重叠,如CCl4,含有极性键,但为正四面体结构,为非极性分子,故C错误;
D.氢键不属于化学键,为分子间作用力的一种,故D错误.
故选B.
点评 本题综合考查原子结构与元素周期率,侧重物质的结构、性质的比较,注意把握元素周期率的递变规律,把握物质的结构、性质的比较角度,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 外围电子就是最外层电子 | |
| B. | 最外层电子数小于4的元素一定是金属元素 | |
| C. | 过渡元素的最外层电子数一般为1个或2个 | |
| D. | 如果某元素最外层电子数是1个或2个,次外层电子数为18个,此元素是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏时把温度计插入液面下 | |
| B. | 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制银镜 | |
| C. | 检验卤代烷中的卤素元素可先将卤代烷与NaOH溶液混合加热,然后加入AgNO3溶液,根据生成沉淀的颜色初步确定卤素 | |
| D. | 用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
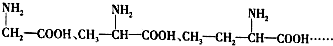
 ,B
,B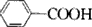 ,CCH2(NH2)COOH.
,CCH2(NH2)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Cl2 (g) | HCl(g) | 饱和NaCl溶液、浓硫酸 | 洗气 |
| B | Na2CO3(aq) | NaHCO3(aq) | 过量NaOH溶液 | 洗液 |
| C | 铁粉(s) | 铝粉(s) | 过量NaOH溶液 | 过滤 |
| D | FeCl3(aq) | AlCl3(aq) | 过量氨水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
| B. | N原子的轨道表示式: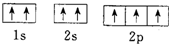 违反了泡利不相容原理 违反了泡利不相容原理 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(23V)1s22s22p63s23p63d34s2违反了洪特规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com