
【题目】反应2A+B = 3C+4D(物质均为气体)中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=4 mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医典籍《肘后备急方》所载治疗疟疾的方法“青蒿一握,以水二升渍,绞取汁,尽服之”, 对屠呦呦团队研发治疗疟疾的特效药——青蒿素有巨大的启示作用。屠呦呦在对比实验中发现古法疗效低下,她设计的提取青蒿素的工艺可以简化成如下流程:
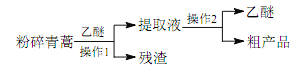
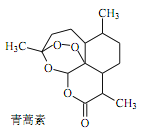
根据上述信息分析,下列判断或叙述中肯定错误的是
A. 从天然植物中提取有效成分治疗疾病是药物研发的重要途径
B. 将青蒿粉碎可以提高有效成分的提取率
C. 青蒿素易溶于水和乙醚
D. 操作 1 是过滤,操作 2 是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是三种稀酸对![]() 合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
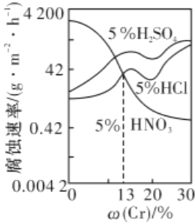
A.稀硝酸对![]() 合金的腐蚀性比稀硫酸和稀盐酸的弱
合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)![]() Fe(NO3)3+3NO2↑+3H2O
Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对![]() 合金的腐蚀性最强
合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对![]() 合金的腐蚀性减弱
合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是( )
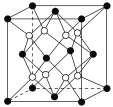
A. 铁镁合金的化学式为Mg2Fe
B. 晶体中存在的化学键类型为金属键
C. 晶格能:氧化钙>氧化镁
D. 该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)按下图所示装置进行实验,并回答下列问题:
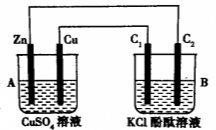
(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 g(“增加”或“减少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
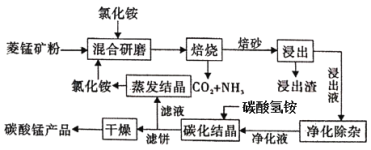
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
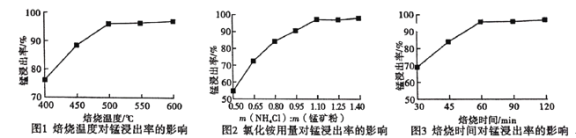
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com