
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
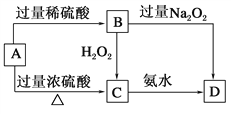
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
【答案】 铁 A在浓硫酸中会钝化,且A与浓硫酸与稀硫酸反应的氧化产物不同 2H++2Fe2++H2O2===2H2O+2Fe3+ 6H2SO4(浓)+2Fe═Fe2(SO4)3+3SO2↑+6H2O
【解析】已知A→C必须加热,否则会发生钝化现象,则A为铁或铝,根据流程图,A与稀硫酸和浓硫酸反应生成不同的产物,其中B能够氧化生成C,则A为铁B为亚铁盐,C为铁盐。
(1) A在浓硫酸中会钝化,且A与浓硫酸与稀硫酸反应的氧化产物不同,因此A是铁,故答案为:铁;A在浓硫酸中会钝化,且A与浓硫酸与稀硫酸反应的氧化产物不同;
(2)硫酸亚铁在酸性条件下与H2O2反应被氧化为铁离子,反应的离子方程式为2H++2Fe2++H2O2===2H2O+2Fe3+,故答案为:2H++2Fe2++H2O2===2H2O+2Fe3+;
(3)铁与过量浓H2SO4反应生成硫酸铁、二氧化硫和水,反应的化学方程式为6H2SO4(浓)+2Fe═Fe2(SO4)3+3SO2↑+6H2O,故答案为:6H2SO4(浓)+2Fe═Fe2(SO4)3+3SO2↑+6H2O。


科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
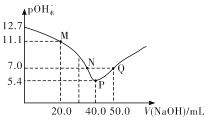
A.水的电离程度:M>PB.图中P点至Q点对应溶液中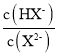 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al、Fe二种金属元素,下列说法正确的是
A. 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼
B. 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2
C. 二者的氢氧化物都不可以通过氧化物化合反应直接制备
D. 二者的单质都能与强碱溶液反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
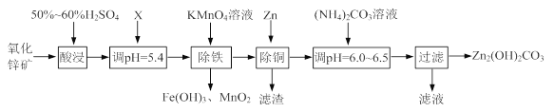
(1)“酸浸”时保持H2SO4过量的目的是_____。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:_____。
②流程中调节pH=5.4所加试剂X为_____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为_____(填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列过程的化学用语表述正确的是
A. 用硫酸铜溶液除去乙炔中的硫化氢气体:H2S + Cu2+=== CuS↓ + 2H+
B. 向氯化铝溶液中滴入过量氨水:Al3+ + 4OH- === AlO2- + 2H2O
C. 用电子式表示Na和Cl形成NaCl的过程:![]()
D. 钢铁发生电化学腐蚀的正极反应:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnCl24H2O和CuCl22H2O的部分实验步骤如图:
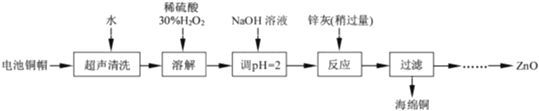
(1)从“滤液Ⅰ”中提取ZnCl24H2O的实验步骤依次为_____、_____、过滤、冰水洗涤、低温干燥
(2)“溶解Ⅱ”步骤中,发生反应的离子方程式为_____
(3)氯化铜溶液中各含铜物种的分布分数与c(Cl﹣)的关系如图。
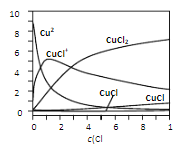
①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为_____
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,生成白色沉淀的离子方程式为_____(任写一个)。
(4)为测定产品中“CuCl22H2O”的纯度,称取0.90g样品,溶于稀硫酸并配成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量的KI充分反应,再向其中逐滴加入0.02000 molL﹣1 Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液2500mL。已知:2Cu2++4I﹣=2CuI(白色)↓+I2;2S2O32﹣+I2═2I﹣+S4O62﹣
①样品配成溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_____、_____
②请依据实验数据计算样品中CuCl22H2O的质量分数(写出计算过程)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中正确的是( )
A.炼铝:用电解氯化铝溶液的方法获得单质铝
B.制钛:用金属钠置换熔融四氯化钛(TiCl4)中的钛
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素

(1)表格中最稳定的元素是_____(填元素符号),h在周期表的位置为_____。
(2)元素i的最高价氧化物对应水化物的化学式为_____
(3)c、d、e三种元素对应的原子半径由大到小的顺序为_____(用元素符号表示)
(4)c、h气态氢化物的稳定性强弱关系是_____(用化学式表示)
(5)写出f和i形成的化合物中所含化学键的类型_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com