
【题目】在一定条件下,反应A(g)+B(g) ![]() C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
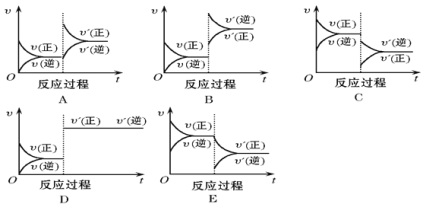
(1)升温,达到新平衡的是________,新平衡中C的体积分数________(填“增大”、“减小”或“不变”,下同)。
(2)降压,达到新平衡的是________,A的转化率________。
(3)减少C的量,达到新平衡的是_______。
(4)增加A的量,达到新平衡的是____,此时B的转化率________,A的转化率________。
(5)使用催化剂,达到平衡的是________, C的质量分数________。
【答案】B 减小 C 减小 E A 增大 减小 D 不变
【解析】
(1)升高温度,正、逆反应速率加快,化学平衡向着吸热方向移动;
(2)降低压强,正、逆反应速率减慢,化学平衡向着气体系数之和增大的方向移动;
(3)减小产物的浓度,平衡正向移动;
(4)增加反应物的浓度,平衡正向移动,本身转化率减小,另一种反应物转化率增大;
(5)使用催化剂,会同等程度的加快正、逆反应速率,平衡不移动。
(1)升高温度,正、逆反应速率瞬间均加快,化学平衡向着吸热方向移动,即向着逆反应方向移动,逆反应速率大于正反应速率,新平衡中产物C的体积分数减小,故答案为:B;减小;
(2)降低压强,正、逆反应速率瞬间均减小,化学平衡向着气体系数之和增大的方向移动,即向着逆反应方向移动,反应物A的转化率会减小,故答案为:C;减小;
(3)减小C的量,即减小产物的浓度,平衡正向移动,逆反应速率突然减小,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,故答案为:E;
(4)增加A的量,即增大反应物的浓度,正反应速率突然增大,使得正反应速率大于逆反应速率,随着反应的进行,逆反应速率逐渐增大,平衡正向移动,A本身转化率减小,另一种反应物B的转化率增大,故答案为:A;增大;减小;
(5)使用催化剂,会同等程度的加快正、逆反应速率,正逆反应速率仍然相等,平衡不移动,C的质量分数不变,故答案为:D;不变。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】下列各物质中,互为同位素的是 __________ ,互为同素异形体的是 ________ ,互为同系物的是______________ ,互为同分异构体的是_____________
①金刚石与石墨 ②12C与14C ③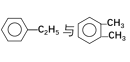 ④
④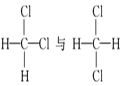 ⑤
⑤ ⑥
⑥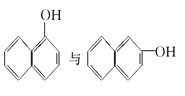 ⑦CH4与C(CH3)4
⑦CH4与C(CH3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X 、Y、Z 的原子序数依次增大,W、X 同主族,Y原子的最外层电子数等于X原子的电子总数,Z原子的电子总数等于W、X、Y 三种原子的电子数之和,Z的最高价氧化物对应水化物的化学式为HnZO2n+2 。W、X、Y 三种元素形成的一种化合物的结构如图所示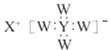 。下列说法错误的是
。下列说法错误的是
A.X常用来制造电池
B.Y、Z形成的化合物常用于制取单质Y
C.W的简单离子半径可能大于X的简单离子半径
D.Z的单质的水溶液需保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组制备消毒液(主要成分是NaClO),设计了下列装置。
已知:Cl2和NaOH溶液能发生下列反应
在加热时:![]()
在低温时:![]()
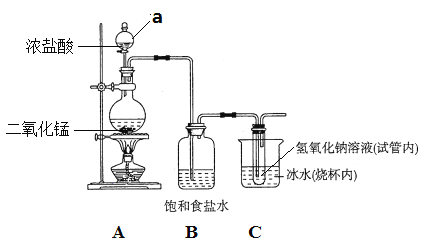
试回答下列问题:
⑴仪器a的名称是_____________。
⑵连接好装置,装药品之前,必须进行的一项操作是_________________。
⑶A装置内发生反应的化学方程式为_______________________________。
⑷B的作用是___________;冰水的作用是__________________________。
⑸该装置的不足之处有___________________________________________。
⑹一定温度下,向NaOH溶液中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
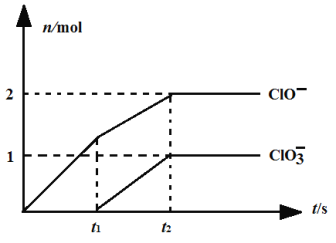
该过程中t2时刻参加反应的Cl2物质的量为_________mol;若另一过程产生的n(Cl-)为5.5mol,n(ClO3-)为1mol,则参加反应的NaOH物质的量为___________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有HCl存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl2存在
D. 加入Na2CO3溶液,有气泡产生,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______种,基态锰原子的外围电子排布式为___,该原子能量最高的电子的电子云轮廓图形状为________。
(2)N、C和Mn电负性由大到小的顺序为____________。
(3)HSCH2CH2NH2中C的杂化方式为_____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
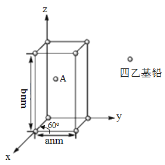
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___,A分子的坐标参数为_____;设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅢA族的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)基态Ga原子价电子排布图为________.
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)铵盐大多不稳定,NH4F、NH4I中,较易分解的是_____,原因是______.
(4)第二周期中,第一电离能介于B元素和N元素之间的元素有______种。
(5)晶体别有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见下图),每个顶点为一个硼原子,每个三角形均为等边三角形。若此结构单元为1个分子,则其分子式为____.

(6)冰晶石(Na3AlF6)由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,ο位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_________ (填微粒符号)。
(7)A1单质的晶体中原子的堆积方式如图乙所示,其晶跑特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若己知Al的原子半径为dnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目_____个;Al晶体的密度为_____g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3:1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
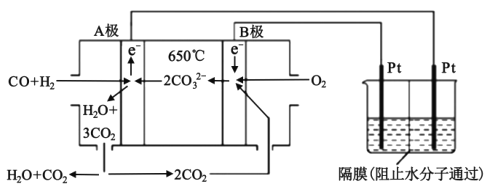
(1)H2(g)、CO(g)的燃烧热△H分别为-285.8kJmol-1、-283.0kJmol-1,18g液态水变为水蒸气时吸热44.0kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的△H=___kJmol-1,B电极上发生反应的电极反应式为___。
(2)若以此电源生产新型硝化剂N2O5,装置如图所示。已知两室加入的试剂分别是a.硝酸溶液;b.N2O4+无水硝酸,则左室加入的试剂应为___(填“a”或“b”),其电极反应式为___。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___L。电解后溶液体积为500mL,溶液的pH约为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com