
【题目】CCTV“科技博览”栏目报道,我国科学家首创以CO2为原料制备可降解塑料——聚二氧化碳。下列相关说法合理的是( )
A. 聚二氧化碳塑料属于高分子化合物
B. 聚二氧化碳塑料是无机化合物
C. 聚二氧化碳塑料中含有CO2分子
D. 使用聚二氧化碳塑料易造成环境污染
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】国内外医学界最新研究表明,如果人体不缺乏微量元素而随意过量补充的话,不仅对健康无益反而有害,下列元素属于微量元素的是( )
A. Fe B. Ca
C. H D. K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是
A.豆浆中加入CaSO4制豆腐
B.清晨在茂密的森林里看到缕缕阳光穿过林木枝叶
C.FeCl3溶液中加入NaOH溶液产生红褐色沉淀
D.江河入海口常有三角洲形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于普通玻璃的叙述中,正确的是( )
A. 它是人类最早使用的硅酸盐材料
B. 红色玻璃中含氧化亚铜
C. 它在加热熔化时有固定的熔点
D. 无色玻璃是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol﹒L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质溶于水的过程中通常伴随着能量的变化,下表为四种物质的溶解热(“+”表示吸热,“-”表示放热)。
化学式 | NH4NO3 | NaOH | Ba(NO3)2 | KNO3 |
溶解热(kJ/mol) | +4.13 | -26.01 | + 1.57 | +3.49 |
将等物质的话的上述物质分别加入等质量的水中,所得溶液中水的离子积常数Kw最小的是
A. NH4NO3 B. NaOH C. KNO3 D. Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用。回答下列问题:
(1)已知:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示。
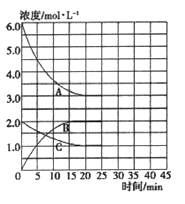
① 计算在该温度下反应2NH3(g) ![]() N2(g)+3H2(g)的平衡常数K=________。
N2(g)+3H2(g)的平衡常数K=________。
② 在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡。在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线。________
③ 已知:2N2(g)+6H2O(l) ![]() 4NH3(g)+3O2(g)△H=+1530.0KJ/mol则氢气的热值为_____。
4NH3(g)+3O2(g)△H=+1530.0KJ/mol则氢气的热值为_____。
(2)① N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:__________
② 用NaClO与NH3 制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-=OH-+NH2Cl
请写出第二步离子方程式:__________________
③ N2H4易溶于水,是与氨相类似的弱碱,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2 mol/L N2H4·H2O与0.lmol/L,盐酸等体积混合(忽略体积变化)。则此时溶液的PH等于________(忽略N2H4的二级电离)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
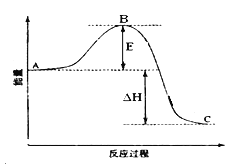
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”)。
(2)图中△H= kJ·mol-1;
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com