
【题目】某温度下,向一定体积0.1molL﹣1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=﹣lgc(OH﹣)]与 pH 的变化关系如,图所示,则( ) 
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中 c(CH3COO﹣)>c(Na+)
C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
D.M点和N点所示溶液中水的电离程度相同
【答案】D
【解析】解:A.M点主要是醋酸,Q点主要是醋酸钠,由于醋酸是弱酸,电离程度很小,离子浓度也较小,所以M点所示溶液的导电能力弱于Q点,故A错误;
B.N点所示溶液为碱性,则c(OH﹣)>c(H+),根据溶液电荷守恒c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+),可判断出此时c(Na+)>c(CH3COO﹣),故B错误;
C.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,故C错误;
D.由于M点的OH﹣浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故D正确.
故选D.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
2X(g)+Y(g)2Z(g),X的转化率随时间的变化关系如图所示.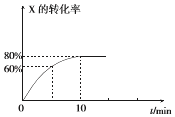
(1)第2min时的反应速率v1(X)(填“大于”、“小于”或“等于”)第8min时的反应速率可v2(X),原因是 .
(2)反应在0~10min内Y的平均反应速率v(Y)=molL﹣1min﹣l .
(3)T1℃温度下反应的平衡常数K1为 , 若在第10min后压缩容器容积,X的转化率(填“增大”、“减小”或“不变”,下同),平衡常数 .
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H0(填“大于”或“小于”).
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)2NO2(g)达到平衡时NO的转化率,则压强最大的点为( ) 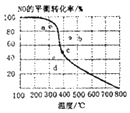
A.a
B.b
C.c
D.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100℃下,水的离子积KW=1×10﹣12 , 下列说法正确的是( )
A.0.05 molL﹣1 的 H2SO4 溶液 pH=1
B.0.001 molL﹣1 的 NaOH 溶液 pH=11
C.0.005 molL﹣1的H2SO4溶液与0.01 molL﹣1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滥用药物有碍健康,下列有关用药的叙述正确的是( )
A.长期大量服用阿司匹林可预防感冒
B.运动员长期服用麻黄碱可提高成绩
C.服用氢氧化钠溶液可中和过多的胃酸
D.注射青霉素前要先做皮肤敏感试验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W 的气态氢化物具有相同的电子数,X元素可以组成M和N两种气态单质,反应 M + 2I-+ 2H+= I2 + N + H2O 常作为 M 的鉴定反应。
(1)M与N的关系为_____________________
(2)写出实验室制取W2的离子方程式____________________________ 。
(3)成外高一某化学兴趣小组设计下图所示的实验装置(图中夹持和加热装置略去),分别探究 YX2和W2 的性质。

①分别通入 YX2 和 W2 时,在装置 A 中观察到的现象是否相同?__________(填“相同”或“不相同”)。
若装置 D 中装的是铁粉,当通入 W2 时观察到的现象为_______________________________________; 若装置 D 中装的是五氧化二钒(V2O5),当通入 YX2 时,打开 K 放入适量的氧气,在 D 装置中发生反应的化学方程式为___________________________________________。
②若装置 B 中装有 5.0 mL 1.0×10-3 mol/L 的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为_______________________________
(4)某同学将足量的 YX2 通入一支装有 BaCl2 溶液的试管,未见沉淀生成,向该试管中加入适量(填字母) ___________,可以看到白色沉淀产生。
A.氨水 B.稀盐酸C.稀硝酸 D.CaCl2 溶液
(5)若Y和X组成的负二价阴离子Z,Z中Y和X的质量比为 Y∶X = 4∶3,当 W2 与含Z的溶液完全反应后,有黄色沉淀生成,取上层淸液加入 BaCl2 溶液,有白色沉淀产生,该反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示 
(1)若改变反应条件,在某条件下a(I2)的变化如曲 线(I )所示,则该条件可能是:(填序号)
①恒容条件下,升高温度
②恒温条件下,缩小反应容器体积
③恒温条件下,扩大反应容器体积
④恒温、恒容条件下,加入适当催化剂
(2)该温度下此化学反应的化学平衡常数为 .
(3)在图基础上画出恒容条件下,降低温度,I2的转化率a(I2)随时间变化的曲线 .
(4)若在原平衡的基础上,保持体系温度不变,再往体系中通入1.4mol I2(g)和0.6mol HI(g),计算再次达到平衡时I2(g)的物质的量.(写出计算过程,已知最后结果保留2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com