
| A. | 常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液pH=8,则混合溶液中水电离产生的c(OH-)=1×10-8 | |
| B. | 室温下,CH3COONa和CaCl2的混合溶液:c (Na+)+c(Ca2+)=c (CH3COO-)+c(CH3COOH)+c(Cl-) | |
| C. | 恒容密闭容器中进行反应2A2(g)+B2(g)?2A2B(g)△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 | |
| D. | 常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,则混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
分析 A.二者恰好反应生成NaB,溶液pH=8,说明混合溶液中A-水解,溶液中的氢氧根离子是水电离的;
B.根据混合液中的物料守恒判断;
C.升高温度,平衡向着吸热的反应方向移动;
D.二者恰好反应,说明氨水的浓度为0.1mol/L,结合反应后溶液中物料守恒判断.
解答 解:A.常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,恰好完全反应,测得混合溶液pH=8,则混合溶液中A-水解,溶液中的氢氧根离子是水电离的,则由水电离产生的c(OH-)=10-6mol/L,故A错误;
B.室温下,CH3COONa和CaCl2的混合溶液,根据物料守恒可得:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-),故B错误;
C.该反应的△H<0,是放热反应,达到化学平衡后,加热,平衡向吸热的逆反应方向移动,会使逆反应速率大于正反应速率,故C正确;
D.常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,根据物料守恒,则混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=c(Cl-)=5×10-2mol/L,故D错误,
故选C.
点评 本题考查化学反应速率和化学平衡移动原理,水的电离及溶液中离子浓度大小的比较,旨在考查水的电离平衡、化学平衡移动原理、溶液中的物料守恒的应用:酸碱恰好反应后溶液呈碱性,则溶液中酸根离子水解,由水电离产生的氢离子和氢氧根离子浓度相等,溶液中的氢氧根离子只有水电离产生;注意溶液中三个守恒定律(电荷守恒、质子守恒和物料守恒)的灵活应用;熟记勒夏特列原理.


科目:高中化学 来源: 题型:选择题
| A. | CH4分子的球棍模型: | B. | 聚氯乙烯的结构简式为CH2CHCl | ||
| C. | 3,3-二甲基-1-戊烯的键线式: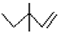 | D. | 乙醇分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(298K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
| A. | 等物质的量浓度的硼酸溶液和碳酸氢钠溶液比较,pH:后者>前者 | |
| B. | 等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 | |
| C. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| D. | 将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | I | II | III |
| 实验 |  |  |  |
| 现象 | 有白色沉淀生成,滤液为蓝色 | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | |
| 化学方程式 | 2AgNO3+CuCl2═2AgCl↓+Cu(NO3)2 | ||
| 离子方程式 | Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为检验Pb(NO3)2热分解的产物,有人用示意图中装置进行实验.(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)
为检验Pb(NO3)2热分解的产物,有人用示意图中装置进行实验.(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液一定显碱性 | B. | 溶液不可能显碱性 | ||
| C. | 溶液可能显碱性 | D. | 溶液不可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ①②③⑥ | C. | ①③④⑤⑦ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com