
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。
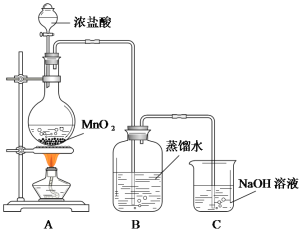
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)C装置的作用是__________________________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:______________________________________________________;
化学性质变化:_______________________________________________________。
(3)乙同学从B中取出一定量的样品后通入SO2,充分作用后再滴入少量品红溶液,发现品红溶液不褪色。原因是__________________________________(用离子方程式表示)。丙同学改变通入SO2的量,重复乙同学的操作,发现品红溶液红色褪去。他提出:假设①:SO2过量,多余的SO2使品红溶液褪色;假设②:_________________________。请设计实验验证假设①是否成立:______________________。
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂a应选择_______________;试剂b应选择_______________。
(5)戊同学从B中取出少量样品,滴到NaHCO3粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由________。
【答案】吸收多余氯气 溶液颜色变浅 溶液酸性增强(或漂白性减弱等) SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl— SO2少量,多余的Cl2使品红溶液褪色 加热该溶液,若溶液恢复成红色,则假设①成立 CaCl2 碱石灰 不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸
【解析】
(1)C装置的作用是尾气处理,吸收多余氯气。
(2)次氯酸见光分解2HClO![]() 2HCl+O2↑,Cl2+H2O
2HCl+O2↑,Cl2+H2O![]() HCl+HClO平衡向右移动。
HCl+HClO平衡向右移动。
(3)SO2和Cl2发生氧化还原反应生成盐酸和硫酸,SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl—。
(4)试剂a是干燥氯气的,氯气和氯化钙不反应,可以用CaCl2,球形干燥管是吸收多余氯气的,防止污染空气,故用碱石灰。
(5)因为浓盐酸具有挥发性,会挥发出HCl进入B中,使溶液中存在盐酸,故评价不正确。
(1)C装置的作用是尾气处理,吸收多余氯气,故答案为:吸收多余氯气。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,次氯酸见光分解2HClO![]() 2HCl+O2↑,Cl2+H2O
2HCl+O2↑,Cl2+H2O![]() HCl+HClO平衡向右移动,溶液颜色变浅,次氯酸是弱酸,分解生成盐酸,盐酸是强酸,所以溶液酸性增强(或漂白性减弱),故答案为:溶液颜色变浅 ;溶液酸性增强(或漂白性减弱等)。
HCl+HClO平衡向右移动,溶液颜色变浅,次氯酸是弱酸,分解生成盐酸,盐酸是强酸,所以溶液酸性增强(或漂白性减弱),故答案为:溶液颜色变浅 ;溶液酸性增强(或漂白性减弱等)。
(3)SO2和Cl2发生氧化还原反应生成盐酸和硫酸,SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl—,
假设①:SO2过量,多余的SO2使品红溶液褪色;因为SO2和氯水都能漂白品红,假设②:SO2少量,多余的Cl2使品红溶液褪色;SO2的漂白性只是暂时的,没有持久性,为了验证假设①是否成立,可以加热该溶液,若溶液恢复成红色,则假设①成立,故答案为:SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl—;SO2少量,多余的Cl2使品红溶液褪色;加热该溶液,若溶液恢复成红色,则假设①成立。
(4)试剂a是干燥氯气的,氯气和氯化钙不反应,可以用CaCl2,球形干燥管是吸收多余氯气的,防止污染空气,故用碱石灰,故答案为:CaCl2;碱石灰。
(5)因为浓盐酸具有挥发性,会挥发出HCl进入B中,使溶液中存在盐酸,故评价不正确,故答案为:不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。


科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
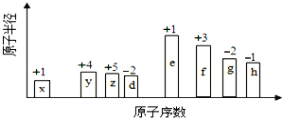
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:
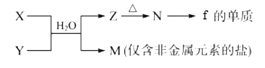
①写出X溶液与Y溶液反应的离子方程式____________________________________;
②写出工业上制备f的单质的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应COCl2(g)![]() CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦增加COCl2的浓度;能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦增加COCl2的浓度;能提高COCl2转化率的是
A. ①④⑦ B. ③⑤⑥ C. ②③⑦ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的用途正确的是( )
A.高纯单质硅用于制光导纤维
B.二氧化硅用于制太阳能电池
C.硅酸钠溶液是制木材防火剂的原料
D.硅胶常用作瓶装药品的抗氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是

A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com