
| 1 |
| 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
F2+H2 2HF 2HF |
1.8×1036 | 1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 | 4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 | 9.3×106 |
I2+H2 2HI 2HI |
43 | 34 |


查看答案和解析>>
科目:高中化学 来源: 题型:
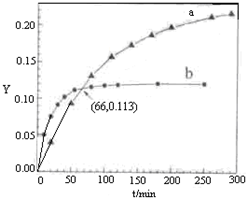 (2011?北京)已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
(2011?北京)已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
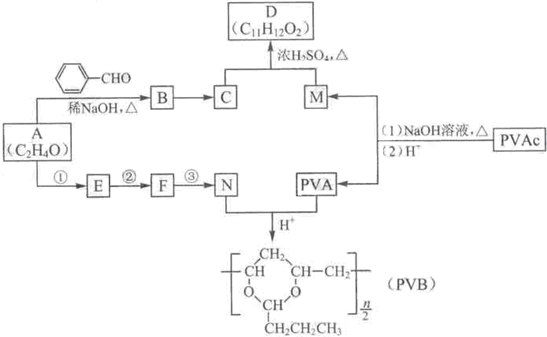
| ||
| △ |
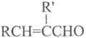 +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)
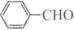 合成B的化学方程式是
合成B的化学方程式是







查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com