
 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).分析 (1)据已知“傅-克”反应和X加氢的产物 分析X的结构,
分析X的结构, 含有醇羟基,在浓硫酸存在时,加热发生消去反应;
含有醇羟基,在浓硫酸存在时,加热发生消去反应;
(2) 的同分异构体能与NaOH反应,说明含有羟基,苯环上有互为对位的2个取代基,则其对位有丙烯基,丙烯基有3种;
的同分异构体能与NaOH反应,说明含有羟基,苯环上有互为对位的2个取代基,则其对位有丙烯基,丙烯基有3种;
(3) 中有羰基、氯原子和苯环,据其含有的官能团分析其具有的性质;
中有羰基、氯原子和苯环,据其含有的官能团分析其具有的性质;
(4)首先用乙烯制取1,2-二氯乙烷,再消去制取氯乙烯,氯乙烯在酸性高锰酸钾溶液中被氧化为氯乙酸,再与SOCl2反应制取ClOCCl,通过“傅-克”反应制取 .
.
解答 解:(1)据“傅-克”反应和X催化加氢生成 ,可知X为
,可知X为 ,
, 含有醇羟基,在浓硫酸存在时,加热发生消去反应生成
含有醇羟基,在浓硫酸存在时,加热发生消去反应生成 ,故答案为:
,故答案为: ;
; ;
;
(2) 的同分异构体能与NaOH反应,说明含有羟基,苯环上有互为对位的2个取代基,则其对位有丙烯基,丙烯基有3种,所以其同分异构体有:
的同分异构体能与NaOH反应,说明含有羟基,苯环上有互为对位的2个取代基,则其对位有丙烯基,丙烯基有3种,所以其同分异构体有: ,故答案为:
,故答案为: ;
;
(3) 中有苯环和氯原子,能够发生取代反应,不能被氧化,羰基和苯环都能够催化加氢,能够发生还原反应,其不溶于水,故答案为:AD;
中有苯环和氯原子,能够发生取代反应,不能被氧化,羰基和苯环都能够催化加氢,能够发生还原反应,其不溶于水,故答案为:AD;
(4)CH2=CH2$\stackrel{氯水}{→}$CH2ClCH2Cl$→_{△}^{NaOH的乙醇溶液}$CHCl=CH2$\stackrel{酸性高锰酸钾}{→}$ClCOOH$\stackrel{SOCl_{2}}{→}$ClCOCl$→_{“傅克反应”}^{苯}$ ,
,
故答案为:CH2=CH2$\stackrel{氯水}{→}$CH2ClCH2Cl$→_{△}^{NaOH的乙醇溶液}$CHCl=CH2$\stackrel{酸性高锰酸钾}{→}$ClCOOH$\stackrel{SOCl_{2}}{→}$ClCOCl$→_{“傅克反应”}^{苯}$ .
.
点评 本题考查有机合成,题目难度中等,该题为有机合成的典型题目,从合成条件和给出的信息分析可以得到各个点的结构,从而能够将各个题目破解,熟练掌握常见有机物结构与性质为解答关键.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
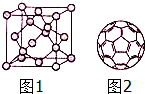 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义. 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
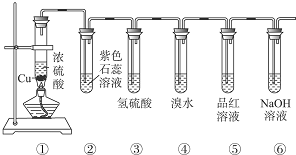
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
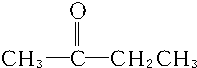 C:CH2═CH-CH2CH3或CH3CH═CH-CH3.
C:CH2═CH-CH2CH3或CH3CH═CH-CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+8-m-n | B. | a+16-m-n | C. | a-8-(m+n) | D. | a-(m+n) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
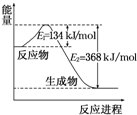 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年来太原市为建设“美丽太原”实施了一系列重要举措.
近年来太原市为建设“美丽太原”实施了一系列重要举措.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com