
【题目】(1)标准状况下,1.806×1022个NH3分子的体积为 ,氢原子的物质的量为 ,溶于水形成200ml溶液所得氨水的物质的量浓度为 。
(2)将7.1g Na2SO4溶于水配成200mL溶液,溶液中Na+的物质的量浓度为__________。向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.6mol·L-1(假设溶液体积不变)需加入NaCl的质量为__________。
(3)有FeCl2、CuCl2混合溶液400 mL,经测定其中Cl- 浓度是a mol / L。投入过量的锌粉b g,充分反应后过滤,所得固体残渣洗涤干燥后,质量为c g。则原混合溶液中Fe2+是_________ mol / L,Cu2+是_________mol / L。
【答案】
(1)0.672L;0.09mol;0.15mol/L;
(2)0.5mol/L;1.17g;
(3)![]() (5b-5c-a)mol/L;
(5b-5c-a)mol/L;![]() (9a-5b+5c)mol/L。
(9a-5b+5c)mol/L。
【解析】
试题分析:(1)标准状况下,1.806×1022个NH3分子的物质的量=![]() =0.03mol,体积为0.03mol×22.4L/mol=0.672L,氢原子的物质的量为0.03mol×3=0.09mol,溶于水形成200ml溶液所得氨水的物质的量浓度=
=0.03mol,体积为0.03mol×22.4L/mol=0.672L,氢原子的物质的量为0.03mol×3=0.09mol,溶于水形成200ml溶液所得氨水的物质的量浓度=![]() =0.15mol/L,故答案为:0.672L;0.09mol;0.15mol/L;
=0.15mol/L,故答案为:0.672L;0.09mol;0.15mol/L;
(2)7.1g Na2SO4的物质的量=![]() =0.05mol,配成200mL溶液,溶液中Na+的物质的量浓度=
=0.05mol,配成200mL溶液,溶液中Na+的物质的量浓度=![]() =0.5mol/L,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.6mol·L-1,溶液中含有氯化钠的物质的量=0.6mol/L×0.2L=0.12mol,需加入NaCl的质量为(0.12mol-2×0.05mol)×58.5g/mol=1.17g,故答案为:0.5mol/L;1.17g;
=0.5mol/L,向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.6mol·L-1,溶液中含有氯化钠的物质的量=0.6mol/L×0.2L=0.12mol,需加入NaCl的质量为(0.12mol-2×0.05mol)×58.5g/mol=1.17g,故答案为:0.5mol/L;1.17g;
(3)Zn的活泼性大于Fe、Cu,所以Zn能置换出Fe、Cu,该混合溶液中根据化学式得n(Fe2+)+n(Cu2+)=![]() n(Cl-)=amol/L×0.4L=0.2amol,Zn的摩尔质量大于Fe、Cu,所以Zn置换出Fe、Cu时导致固体质量减少(b-c)g,设FeCl2和CuCl2分别为xmol、ymol,则:
n(Cl-)=amol/L×0.4L=0.2amol,Zn的摩尔质量大于Fe、Cu,所以Zn置换出Fe、Cu时导致固体质量减少(b-c)g,设FeCl2和CuCl2分别为xmol、ymol,则:
Zn+Cu2+=Cu+Zn2+ 质量减少
1mol 1g
ymol yg
Zn+Fe2+=Fe+Zn2+ 质量减少
1mol 9g
xmol 9xg
可得方程组:x+y=0.2a,9x+y=bc,解得x=![]() (bc0.2a),y=
(bc0.2a),y=![]() (1.8ab+c),故c(Fe2+)=
(1.8ab+c),故c(Fe2+)= =
=![]() (5b-5c-a)mol/L,c(Cu2+)=
(5b-5c-a)mol/L,c(Cu2+)= =
=![]() (9a-5b+5c)mol/L故答案为:
(9a-5b+5c)mol/L故答案为:![]() (5b-5c-a)mol/L;
(5b-5c-a)mol/L;![]() (9a-5b+5c)mol/L。
(9a-5b+5c)mol/L。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在4℃时,100 mL水中溶解了 22.4 L HCl气体(标准状况下测得)后形成溶液。下列说法正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2CO3的混合物放在密闭的容器中加热,充分反应后,测得容器中CO2的体积为4.48L(标准状况)。将反应后的固体与200ml某浓度的盐酸恰好完全反应,转化为8.96LCO2。试回答:(注2NaHCO3![]() Na2CO3 +CO2
Na2CO3 +CO2![]() +H2O)
+H2O)
(1)盐酸的物质的量浓度为多少?__________
(2)原混合物中NaHCO3质量为________;Na2CO3的质量为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl一由正极向负极迁移
D.负极会发生副反应 Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法错误的是( )
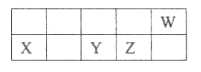
A. 原子半径由大到小的顺序:X、Y、Z、W
B. 元素最高正价由低到高的顺序:X、Y、Z、W
C. 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W
D. 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+ 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2 s末浓度/mol·L-1 0.6 1.8 1.0
4 s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2 s末氨气的反应速率为0.4 mol·L-1·s-1
B.前2 s时间内氨气的平均反应速率为0.4 mol·L-1·s-1
C.前4 s时间内氨气的平均反应速率为0.3 mol·L-1·s-1
D.2~4 s时间内氨气的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g) ![]() 2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com