
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
分析 A、化学反应除物质变化外还有能量变化;
B、物质燃烧和酸碱中和反应均是放热反应;
C、反应吸热还是放热与反应条件无关,决定于反应物和生成物的能量高低;
D、化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
解答 解:A、化学反应既有物质变化又有能量变化,故A正确;
B、物质燃烧和酸碱中和反应均是放热反应,放出热量,故B正确;
C、反应吸热还是放热与反应条件无关,故C错误;
D、放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故D正确;
故选C.
点评 本题考查了化学变化过程中的热效应,题目难度不大,正确理解放、热吸热的本质是解题的关键.


科目:高中化学 来源: 题型:实验题
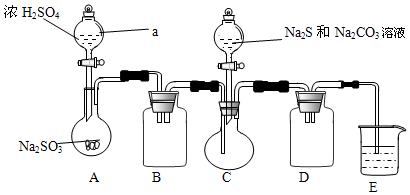
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
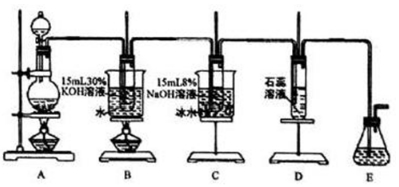
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ------------- |
| 步骤2: 向A试管中加入1-2mL 0.0lmol•L-1 KMnO4溶液,振荡试管 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3: 向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
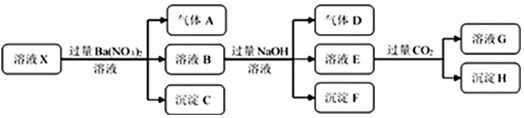
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100mL,产生的气体A为112mL(标况),则X中c(Fe2+)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .请回答下列问题:
.请回答下列问题:| W | X | Y |
| Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
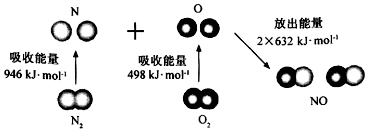
| A. | 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 | |
| C. | 断裂1 mol NO分子中的化学键,需要吸收632KJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=0.03mol•L-1•s-1 | B. | v(NO2)=0.7mol•L-1•min-1 | ||
| C. | v(N2)=0.4mol•L-1•min-1 | D. | v(CO2)=1.1mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ①②④⑤ | C. | ①③⑥ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com