
| A、煤加强热而分解的过程叫做煤的干馏 |
| B、煤干馏的目的是得到冶金用的优质焦炭 |
| C、煤的干馏和石油的分馏的本质差别是:干馏是物理变化,而分馏是化学变化 |
| D、工业上苯等芳香烃原料可由煤干馏得到,其存在于干馏所得的焦炉气中 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸发皿中,用酒精灯加热蒸发NaHCO3溶液,可以得到NaHCO3固体 |
| B、用丁达尔现象可以区分食盐水和淀粉溶液 |
| C、在酸碱中和滴定实验中,锥形瓶要用待测溶液润洗 |
| D、欲配置1.0L 1.00 mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=m+17Vc | ||||
B、c=
| ||||
C、p=m+
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
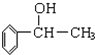 所示:
所示:查看答案和解析>>
科目:高中化学 来源: 题型:
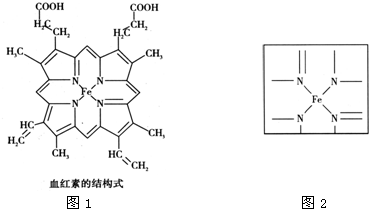
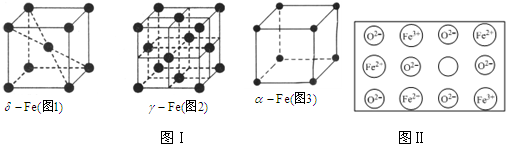
查看答案和解析>>
科目:高中化学 来源: 题型:
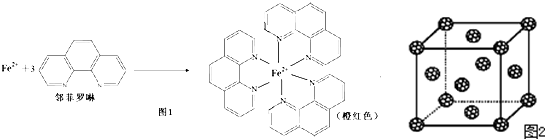
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na | B、Cl | C、Br | D、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com