B
分析:①依据n=

计算物质的量结合熔融状态硫酸氢钾电离出硫酸氢根离子和钾离子分析;
②溶液体积不知,不能计算微粒数;
③依据n=

计算物质的量,Na
2S和Na
2O
2的摩尔质量相同,结合化合物结构计算阴离子数;
④二氧化硫和氧气反应是可逆反应不能进行彻底;
⑤氯气和铁反应量不知不能计算判断;
⑥浓硫酸随浓度变稀后不能和铜继续反应;
解答:①熔融状态的KHSO
4的电离方程式为KHSO
4=K
++HSO
4-;6.8g,6.8g熔融状态的KHSO
4物质的量=
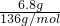
=0.05mol,含0.05mol阳离子,故①错误;
②溶液体积不知不能计算微粒数,故②错误;
③Na
2S中阴离子为S
2-,Na
2O
2的物质的量为O
22-,Na
2S和Na
2O
2的摩尔质量相同为78g/mol,7.8g Na
2S和Na
2O
2的固体混合物物质的量为0.1mol,含有的阴离子数等于0.1N
A,故③错误;
④可逆反应不能进行彻底,2molSO
2和1molO
2,混合气体在催化剂作用下反应容器中物质分子数大于2N
A,故④正确;
⑤铁的量不知,不能计算电子转移,故⑤错误;
⑥浓硫酸与足量铜反应一段时间后,浓硫酸变为稀硫酸后,铜不与稀硫酸反应,生成二氧化硫的分子数小于0.1N
A,故⑥错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,物质构成微粒的分析判断,可能反应的理解应用,注意浓硫酸变稀后不与铜反应,题目难度中等.

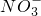 的数目为2NA
的数目为2NA 计算物质的量结合熔融状态硫酸氢钾电离出硫酸氢根离子和钾离子分析;
计算物质的量结合熔融状态硫酸氢钾电离出硫酸氢根离子和钾离子分析; 计算物质的量,Na2S和Na2O2的摩尔质量相同,结合化合物结构计算阴离子数;
计算物质的量,Na2S和Na2O2的摩尔质量相同,结合化合物结构计算阴离子数;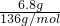 =0.05mol,含0.05mol阳离子,故①错误;
=0.05mol,含0.05mol阳离子,故①错误;
