
ΓΨΧβΡΩΓΩΥΡ¬»Μ·ν―≥ΘΈ¬œ¬ΈΣΈό…Ϊ“ΚΧεΘ§»έΒψΘ≠23.2ΓφΘ§Ζ–Βψ136.4ΓφΘ§ΦΪ“ΉΥ°ΫβΓΘ‘Ύ900Γφ ±Θ§ΫΪ¬»ΤχΆ®Ιΐν―ΧζΩσ(÷ς“Σ≥…Ζ÷ «FeTiO3)ΚΆΧΩΖέΒΡΜλΚœΈοΩ…Ζ¥”Π…ζ≥…ΥΡ¬»Μ·ν―ΚΆ¬»Μ·Χζ(»έΒψ306ΓφΘ§Ζ–Βψ315Γφ)Θ§Ά§ ±≤ζ…ζ“Μ÷÷”–ΕΨΤχΧεΓΘœ÷÷Τ»Γ≤Δ ’Φ·ΥΡ¬»Μ·ν―ΒΡΉΑ÷Ο»γΆΦΥυ Ψ(Φ–≥÷ΉΑ÷Ο¬‘»Ξ)ΓΘ
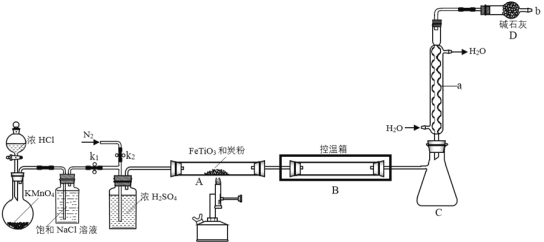
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)“«ΤςaΒΡΟϊ≥Τ «____ΓΘΉιΉΑΚΟ“«ΤςΘ§ΟΜΦ” ‘ΦΝΖ¥”Π«ΑΘ§”ΠΗΟΫχ––ΒΡ≤ΌΉς «_____ΓΘ
(2)Ζ¥”ΠΩΣ Φ«ΑΘ§œ»ΫΪν―ΧζΩσΖέΥιΘ§≤Δ”κ…‘ΙΐΝΩΒΡΧΩΖέΜλΚœΨυ‘»Θ§÷Τ≥…ΕύΩΉΉ¥ΙΧΧεΜλΚœΈοΘ§ΡΩΒΡ «______________ΓΘ
(3) Β―ι÷––ηΆ®»κN2ΝΫ¥ΈΘ§ΒΎΕΰ¥ΈΆ®N2ΒΡΉς”Ο «_________ΓΘ
(4)900Γφ ±Θ§AΉΑ÷Ο÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ__________ΓΘ
(5)BΉΑ÷Ο÷–ΩΊΈ¬œδΈ¬Ε»‘Ύ150ΓΪ200ΓφΘ§ΡΩΒΡ «___________ΓΘ
(6)ΉΑ÷Οb¥Π¥φ‘ΎΒΡ»±Βψ «________________ΓΘ
(7)≤ζΈοTiCl4‘Ύ»»≥± ΣΩ’Τχ÷–ΓΑΖΔ―ΧΓ±…ζ≥…TiO2xH2OΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣ_________ΓΘ
ΓΨ¥πΑΗΓΩ«ρ–ΈάδΡΐΙή Φλ≤ιΉΑ÷ΟΒΡΤχΟή–‘ ‘ω¥σΫ”¥ΞΟφΜΐΘ§ ΙΖ¥”ΠΗϋ≥δΖ÷Θ§ΧΩΖέ…‘ΙΐΝΩΘ§ΧαΗΏν―ΧζΩσάϊ”Ο¬ ΫΪ…ζ≥…ΒΡTiCl4ΤχΧεΆξ»Ϊ≈≈»κCΉΑ÷Ο÷– 2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO άδΡΐΜρΡΐΫαFeCl3ΙΧΧεΘ§≥ΐ»ΞFeCl3 »±…ΌΈϋ ’COΖά÷ΙΈέ»Ψ¥σΤχΒΡΉΑ÷Ο TiCl4+(2+x)H2O
2TiCl4+2FeCl3+6CO άδΡΐΜρΡΐΫαFeCl3ΙΧΧεΘ§≥ΐ»ΞFeCl3 »±…ΌΈϋ ’COΖά÷ΙΈέ»Ψ¥σΤχΒΡΉΑ÷Ο TiCl4+(2+x)H2O![]() TiO2xH2O+4HCl
TiO2xH2O+4HCl
ΓΨΫβΈωΓΩ
≈®―ΈΥα”κKMnO4Ζ¥”Π÷Τ»ΓCl2Θ§”…”Ύ≈®―ΈΥαΨΏ”–Μ”ΖΔ–‘Θ§÷Τ»ΓΒΟΒΫΒΡCl2÷–Κ§”–‘”÷ HClΦΑΥ°’τΤχΘ§”Ο±ΞΚΆNaCl»ή“Κ≥ΐ»ΞHClΘ§»ΜΚσΨ≠≈®ΝρΥαΗ…‘οΒΟΒΫ¥ΩΨΜCl2Θ§‘ΎA÷–”κν―ΧζΩσΦΑΫΙΧΩ‘ΎΦ”»» ±ΖΔ…ζΖ¥”Π≤ζ…ζTiCl4ΓΔFeCl3ΦΑΥ°Θ§‘ΎBΉΑ÷Ο÷–ΩΊ÷ΤΈ¬Ε»‘Ύ150ΓΪ200ΓφΘ§ΫΪFeCl3άδΡΐΖ÷άκ≥ΐ»ΞΘ§C ’Φ·≤ζΤΖΘ§DΉΑ÷Ο”ΟΦν ·Μ“Έϋ ’Ζ¥”Π÷– Θ”ύΒΡ¬»ΤχΘ§Ά§ ±Ζά÷ΙΩ’Τχ÷–ΒΡΥ°’τΤχΫχ»κCΉΑ÷ΟΘ§ΒΪΗΟΉΑ÷Ο»±…ΌΕ‘CO¥ΠάμΒΡΉΑ÷ΟΓΘ
(1)“«ΤςaΈΣ«ρ–ΈάδΡΐΙήΘΜΉΑ÷ΟΉιΉΑΚΟ“‘ΚσΘ§Φ”»κ ‘ΦΝ÷°«Α–κΫχ––ΒΡ≤ΌΉς «Φλ≤ιΉΑ÷ΟΒΡΤχΟή–‘ΘΜ
(2) Β―ι÷–œ»ΫΪν―ΧζΩσΖέΥιΘ§≤Δ”κ…‘ΙΐΝΩΒΡΧΩΖέΜλΚœΨυ‘»Θ§÷Τ≥…ΕύΩΉΉ¥ΙΧΧεΜλΚœΈοΘ§Ω…‘ω¥σΖ¥”ΠΈοΫ”¥ΞΟφΘ§ΧΩΖέ…‘ΙΐΝΩΘ§Ω…“‘ΧαΗΏν―ΧζΩσάϊ”Ο¬ ΘΜ
(3) Β―ι÷–ΝΫ¥ΈΆ®»κN2Θ§ΒΎ“Μ¥ΈΆ®»κ «≈≈≥ωΉΑ÷Ο÷–ΒΡΩ’ΤχΘ§Ζά÷ΙΤδΗ…»≈ Β―ιΘ§ΒΎΕΰ¥ΈΆ®»κN2ΒΡΉς”Ο «ΫΪ…ζ≥…ΒΡTiCl4ΤχΧεΆξ»Ϊ≈≈»κάδΡΐΙήά以ΘΜ
(4)Η…‘ο¥ΩΨΜΒΡ¬»Τχ‘ΎA÷–”κFeTiO3ΚΆΧΩΖέΒΡΜλΚœΈοΖ¥”Π…ζ≥…ΥΡ¬»Μ·ν―ΚΆ¬»Μ·ΧζΘ§ΤδΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΈΣΘΚ2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6COΘΜ
2TiCl4+2FeCl3+6COΘΜ
(5)“ρΈΣΖ¥”Π…ζ≥…ΥΡ¬»Μ·ν―ΚΆ¬»Μ·ΧζΘ§ΕχΥΡ¬»Μ·ν―≥ΘΈ¬œ¬ΈΣ“ΚΧεΘ§Ζ–Βψ136.4ΓφΘ§¬»Μ·ΧζΒΡ»έΒψ306ΓφΘ§Ζ–Βψ315ΓφΘ§ΉΑ÷ΟBΒΡΩΊΈ¬œδΈ¬Ε»‘Ύ150ΓΪ200ΓφΘ§ΨΆΩ…“‘ Ι¬»Μ·ΧζΡΐΫαΈΣΙΧΧεΘ§¥”ΕχΩ…“‘»ΟΫΪ…ζ≥…ΒΡTiCl4ΤχΧεΆξ»Ϊ≈≈»κάδΡΐΙήά以ȧ≤Δ«“”ꬻ̷ΧζΖ÷άκΘΜ
(6)DΉΑ÷Ο”ΟΦν ·Μ“Έϋ ’Ζ¥”Π÷– Θ”ύΒΡ¬»ΤχΘ§Ά§ ±Ζά÷ΙΩ’Τχ÷–ΒΡΥ°’τΤχΫχ»κCΉΑ÷ΟΘ§ΒΪΗΟΉΑ÷Ο»±…ΌΕ‘CO¥ΠάμΒΡΉΑ÷ΟΘΜ
(7) ≤ζΈοTiCl4‘Ύ»»≥± ΣΩ’Τχ÷–ΓΑΖΔ―ΧΓ±…ζ≥…TiO2xH2OΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣTiCl4+(x+2)H2O![]() TiO2xH2OΓΐ+4HClΓΘ
TiO2xH2OΓΐ+4HClΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
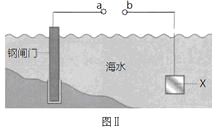
ΓΨΧβΡΩΓΩΆΦΔώΒΡΡΩΒΡ «ΨΪΝΕΆ≠Θ§ΆΦΔρΒΡΡΩΒΡ «±ΘΜΛΗ÷’ΔΟ≈ΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
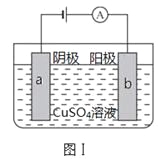
A.ΆΦΔώ÷–aΈΣ¥ΩΆ≠
B.ΆΦΔώ÷–SO42ΓΣœρbΦΪ“ΤΕ·
C.ΆΦΔρ÷–»γΙϊaΓΔbΦδΝ§Ϋ”Βγ‘¥Θ§‘ρaΝ§Ϋ”ΗΚΦΪ
D.ΆΦΔρ÷–»γΙϊaΓΔbΦδ”ΟΒΦœΏΝ§Ϋ”Θ§‘ρXΩ…“‘ «Ά≠
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ÷”– τ”Ύ«ΑΥΡ÷ήΤΎΒΡAΓΔBΓΔCΓΔDΓΔEΓΔFΓΔGΤΏ÷÷‘ΣΥΊΘ§‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΓΘA‘ΣΥΊΒΡΦέΒγΉ”ΙΙ–ΆΈΣnsnnpn+1ΘΜC‘ΣΥΊΈΣΉνΜνΤΟΒΡΖ«Ϋπ τ‘ΣΥΊΘ§D‘ΣΥΊΚΥΆβ”–»ΐΗωΒγΉ”≤ψΘ§ΉνΆβ≤ψΒγΉ” ΐ «ΚΥΆβΒγΉ”Ήή ΐΒΡ1/6ΘΜE‘ΣΥΊ’ΐ»ΐΦέάκΉ”ΒΡ3dΙλΒάΈΣΑκ≥δ¬ζΉ¥Χ§Θ§F‘ΣΥΊΜυΧ§‘≠Ή”ΒΡM≤ψ»Ϊ≥δ¬ζΘ§N≤ψΟΜ”–≥…Ε‘ΒγΉ”Θ§÷Μ”–“ΜΗωΈ¥≥…Ε‘ΒγΉ”ΘΜG‘ΣΥΊ”κA‘ΣΥΊΈΜ”ΎΆ§“Μ÷ςΉεΘ§ΤδΡ≥÷÷―θΜ·Έο”–ΨγΕΨΓΘ
Θ®1Θ©A‘ΣΥΊΒΡΒΎ“ΜΒγάκΡή___B‘ΣΥΊΒΡΒΎ“ΜΒγάκΡήΘ®ΧνΓΑΘΦΓ±ΓΑΘΨΓ±ΜρΓΑ=Γ±Θ©Θ§AΓΔBΓΔC»ΐ÷÷‘ΣΥΊΒγΗΚ–‘”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣ_________________Θ®”Ο‘ΣΥΊΖϊΚ≈±μ ΨΘ©ΓΘ
Θ®2Θ©D‘ΣΥΊ‘≠Ή”ΒΡΦέΒγΉ”≈≈≤Φ Ϋ «______________ΓΘ
Θ®3Θ©C‘ΣΥΊΒΡΒγΉ”≈≈≤ΦΆΦΈΣ________________________ΘΜE3+ΒΡάκΉ”ΖϊΚ≈ΈΣ________ΓΘ
Θ®4Θ©F‘ΣΥΊΈΜ”Ύ‘ΣΥΊ÷ήΤΎ±μΒΡ____«χΘ§ΤδΜυΧ§‘≠Ή”ΒΡΒγΉ”≈≈≤Φ ΫΈΣ______________ΓΘ
Θ®5Θ©G‘ΣΥΊΩ…ΡήΒΡ–‘÷ ______ΓΘ
AΘ°ΤδΒΞ÷ Ω…ΉςΈΣΑκΒΦΧε≤ΡΝœ
BΘ°ΤδΒγΗΚ–‘¥σ”ΎΝΉ
CΘ°ΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·Έο ««ΩΥα
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–”–ΙΊ»ή“Κ÷–ΝΘΉ”≈®Ε»ΒΡΥΒΖ®≤Μ’ΐ»ΖΒΡ «
A.0.1molΓΛL-1NaHCO3»ή“ΚΘΚc(Na+)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.Na2SœΓ»ή“ΚΘΚc(H+)=c(OH-)-2c(H2S)-c(HS-)
C.pH=1ΒΡNaHSO4»ή“ΚΘΚc(H+)=c(SO42-)+c(OH-)
D.Κ§Β»Έο÷ ΒΡΝΩΒΡNaHC2O4ΚΆNa2C2O4ΒΡ»ή“ΚΘΚ2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§≤ΩΖ÷ΥαΒΡΒγάκΤΫΚβ≥Θ ΐ»γœ¬ΘΚ
Μ·―ß Ϋ | HF | HCN | H2CO3 |
Βγάκ≥Θ ΐ | KaΘΫ3.5ΓΝ10©¹4 | KaΘΫ5.0ΓΝ10©¹10 | Ka1ΘΫ4.3ΓΝ10©¹7Θ§ Ka2ΘΫ5.6ΓΝ10©¹11 |
Θ®1Θ©c(H+)œύΆ§ΒΡ»ΐ÷÷ΥαΘ§ΤδΥαΒΡ≈®Ε»¥”¥σΒΫ–ΓΈΣ________________ΓΘ
Θ®2Θ©0.0lmol/LΒΡHCN»ή“Κ÷–Θ§c(H+)‘ΦΈΣ_____mol/LΓΘ Ι¥Υ»ή“Κ÷–HCNΒΡΒγάκ≥ΧΕ»‘ω¥σ«“c(H+)“≤‘ω¥σΒΡΖΫΖ® «_______________________ΓΘ
Θ®3Θ©÷–ΚΆΒ»ΝΩΒΡNaOHΘ§œϊΚΡΒ»pHΒΡ«βΖζΥαΚΆΝρΥαΒΡΧεΜΐΖ÷±πΈΣaLΓΔbLΘ§‘ρa_____bΘ®ΧνΓΑ¥σ”ΎΓ±ΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±Θ§œ¬Ά§Θ©bΓΘ÷–ΚΆΒ»≈®Ε»ΓΔΒ»ΧεΜΐΒΡ«βΖζΥαΚΆΝρΥα–η“ΣNaOHΒΡΈο÷ ΒΡΝΩΈΣn1ΓΔn2Θ§‘ρn1_____n2ΓΘ
Θ®4Θ©œρNaCN÷–Ά®»κ…ΌΝΩΒΡCO2Θ§ΖΔ…ζΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______________ΓΘ
Θ®5Θ©…ηΦΤ Β―ι÷ΛΟς«βΖζΥα±»―ΈΥαΒΡΥα–‘»θ__________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈ“ΙζΩΤ―ßΦ“ Ι”ΟΥΪΙΠΡή¥ΏΜ·ΦΝΘ®ΡήΈϋΗΫ≤ΜΆ§ΝΘΉ”Θ©¥ΏΜ·Υ°ΟΚΤχ±δΜΜΖ¥”ΠΘΚCOΘ®gΘ©+H2OΘ®gΘ©®TCO2Θ®gΘ©+H2Θ®gΘ©ΓςHΘΦ0Θ°‘ΎΒΆΈ¬œ¬ΜώΒΟΗΏΉΣΜ·¬ ”κΗΏΖ¥”ΠΥΌ¬ ΓΘΖ¥”ΠΙΐ≥Χ Ψ“βΆΦ»γΆΦΘΚœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A.ΆΦ Ψœ‘ ΨΘΚΤπ Φ ±ΒΡ 2 ΗωH2OΉν÷’ΕΦ≤Έ”κΝΥΖ¥”Π
B. Ι”Ο¥ΏΜ·ΦΝΫΒΒΆΝΥΥ°ΟΚΤχ±δΜΜΖ¥”ΠΒΡΓςH
C.Ιΐ≥ΧΔώΓΔΙΐ≥ΧΔρΨυΈΣΖ≈»»Ιΐ≥Χ
D.Ιΐ≥ΧΔσ÷Μ…ζ≥…ΝΥΦΪ–‘Ι≤ΦέΦϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Ζ¥”Π÷–Θ§ τ”Ύ»Γ¥ζΖ¥”ΠΒΡ «
ΔΌCH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
ΔΎCH3CH2OH![]() CH2CH2+H2O
CH2CH2+H2O
ΔέCH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
ΔήC6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A.ΔΌΔΎB.ΔέΔήC.ΔΌΔέD.ΔΎΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ““Υα““θΞΙψΖΚ¥φ‘Ύ”Ύ“©ΈοΓΔ»ΨΝœΓΔœψΝœΒ»ΙΛ“ΒΘ§÷–―ßΜ·―ß Β―ι≥Θ”ΟΉΑ÷Οά¥÷Τ±ΗΘΚ
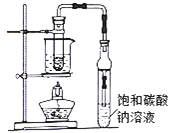
Άξ≥…œ¬Ν–ΧνΩ’ΘΚ
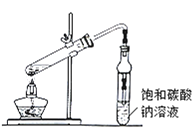
(1)–¥≥ω Β―ι “÷Τ±Η““Υα““θΞΒΡΜ·―ßΖΫ≥Χ ΫΘΚ_______Ά®≥ΘΦ”»κΙΐΝΩ““¥ΦΘ§‘≠“ρ «_______
(2)±ΞΚΆΧΦΥαΡΤ»ή“ΚΒΡΉς”Ο «ΔΌ__________ΔΎ__________
(3)»τ”ΟΉΑ÷Ο÷Τ±Η““Υα““θΞΘ§Τδ»±Βψ”–_________ΓΔ_________ΓΘ±ΏΖ¥”Π±ΏΆ®ΙΐΖ÷“Κ¬©ΕΖ±ΏΒΈΦ”““ΥαΘ§±ΏΦ”»»’τ≥ω““Υα““θΞΓΘ’β―υ≤ΌΉςΩ…“‘ΧαΗΏθΞΒΡ≤ζ¬ ΓΘΤδ‘≠“ρ «______
(4)œ÷ΡβΖ÷άκ¥÷≤ζΤΖ““Υα““θΞΓΔ““ΥαΚΆ““¥ΦΒΡΜλΚœΈοΓΘœ¬Ν–ΩρΆΦ «Ζ÷άκ≤ΌΉς≤Ϋ÷ηΝς≥ΧΆΦΘΚ
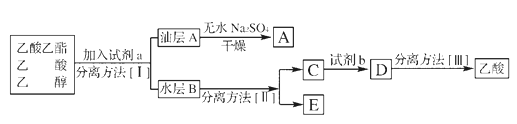
Ζ÷άκΖΫΖ®II «____________ ‘ΦΝb «____________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΓΑΒβΖϋΓ±”÷Ϋ–ΓΑΨέΈ§ΆΣΒβ»ή“ΚΓ±ΓΘΨέΈ§ΆΣΆ®Ιΐ«βΦϋ”κHI3–Έ≥…ΨέΈ§ΆΣΒβΘ§ΤδΫαΙΙ±μ Ψ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
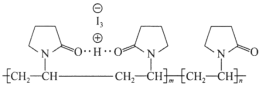 (ΆΦ÷––ιœΏ±μ Ψ«βΦϋ)
(ΆΦ÷––ιœΏ±μ Ψ«βΦϋ)
A.CΓΔNΓΔO‘≠Ή”ΒΡΒγΗΚ–‘“ά¥Έ‘ω¥σ
B.ΨέΈ§ΆΣΒβ÷–Κ§”–άκΉ”ΦϋΓΔΙ≤ΦέΦϋΓΔ«βΦϋΒ»Μ·―ßΦϋ
C.ΨέΈ§ΆΣ“Ή»ή”ΎΥ°ΒΡ‘≠“ρ «”κΥ°Ζ÷Ή”Φδ–Έ≥…«βΦϋ
D.Ζ÷Ή”÷–ΒΡΚ§NΈε‘ΣΜΖ“ΜΕ® «ΤΫΟφΫαΙΙ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com