
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室里需要配制480 mL 0.10 mol·L-1的硫酸铜溶液,实验操作步骤有:
A.在天平上称取所需硫酸铜固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并恢复至室温
B.把所得的溶液小心地转移到容量瓶中
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)___________________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒、药匙,还缺少的仪器是______、___________。
(3)实验过程中需用天平量取___________g无水硫酸铜。
(4)下列情况会使所配溶液浓度偏高的是(填序号)_________________。
a.某同学观察液面的情况如图所示
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)三月万物复苏,很多人会外出踏青旅游。
①自驾游出行方便。制造汽车轮胎的主要材料是____(填字母)。
a.铝合金 b.橡胶 c.玻璃
②高速列车出行快捷。建设铁路需要大量水泥。工业上生产水泥的主要原料是石灰石和____(填字母)。
a.黏土 b.纯碱 c.石英
③轮船出行舒适。为防止轮船钢板被腐蚀,可在钢板上镶嵌____(填字母)。
a.铜块 b.锡块 c.锌块
(2)旅游期间,在娱乐、购物、旅游时要讲究文明、保护环境。
①用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中。聚乙烯的结构简式是____。
②不法商贩会用由铜锌合金打造的假金首饰欺骗消费者。请写出检验金首饰真假的化学方法和结论____。
③不能携带烟花爆竹乘坐公共交通工具。制作烟花爆竹的黑火药是用木炭、硝酸钾、硫磺配制,黑火药爆炸时会生成氮气、硫化钾和二氧化碳。写出该反应的化学方程式____。
(3)在外出行要注意饮食健康。
①面包、牛奶是常见的食物之一,面包对人体的主要作用是____。牛奶中的蛋白质在人体内水解可生成____。
②为保证营养均衡,应摄入适量蔬菜。蔬菜中的膳食纤维对人体的作用是____。
③橙汁是常用饮品。某品牌橙汁中含有维生素C、白砂糖、精制盐、柠檬黄和苯甲酸钠等成分,这几种物质中属于着色剂的是____。缺少维生素C可能会引发的疾病是____。
④饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池。该电池的总反应方程式:xZn + Zn1xMn2O4![]() ZnMn2O4(0 < x < 1)。下列说法正确的是
ZnMn2O4(0 < x < 1)。下列说法正确的是
A. 充电时,Zn2+向ZnMn2O4电极迁移
B. 充电时,阳极反应:ZnMn2O4 2xe—=Zn1-xMn2O4+xZn2+
C. 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g
D. 充放电过程中,只有Zn元素的化合价发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是

A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平方程式 KMnO4+ HCl(浓)- KCl+ MnCl2+ Cl2↑+ H2O,并用双线法分析此反应;___。
(2)指出___是氧化剂,___元素被氧化,氧化产物是___,此反应中,HCl表现的性质有___性和___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:
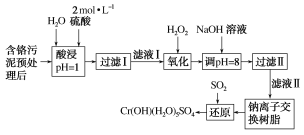
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
③Cr(OH)(H2O)5SO4是难溶物。
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ | |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480 mL2mol·L-1的硫酸,需要量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为___(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:__。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是___(填编号),滴定终点的现象是___。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为______________________________________。
(2)②在水中的电离方程式为______________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式_________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式________。
(4)写出下列反应的离子方程式:
向Ba(OH)2溶液中逐滴加入硫酸溶液___________________________。
向Ba(OH)2溶液中通入过量的CO2_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com