
 ;
; +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr;
+HBr;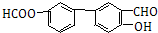 (苯环上基团位置可换);
(苯环上基团位置可换); )
) 的流程图,无机物任选,注明反应条件.
的流程图,无机物任选,注明反应条件.分析 根据题中各物质的转化关系,结合信息提示①,以及反应①的条件可知,能生成 的B应为
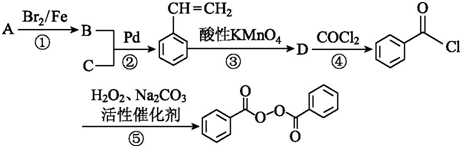
的B应为 ,C应为CH2=CH2,A为
,C应为CH2=CH2,A为 ,苯在Br2/Fe条件下发生取代反应生成
,苯在Br2/Fe条件下发生取代反应生成 ,
, 与CH2=CH2发生反应②为取代反应生成
与CH2=CH2发生反应②为取代反应生成 ,
, 被高锰酸钾氧化得到D,根据信息提示②可知,D为
被高锰酸钾氧化得到D,根据信息提示②可知,D为 ,
, 与COCl2发生取代反应生成
与COCl2发生取代反应生成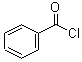 ,
, 与双氧水、碳酸钠在催化剂条件下发生取代反应生成
与双氧水、碳酸钠在催化剂条件下发生取代反应生成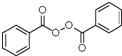 ,
,
(5)乙烯可以和溴水发生加成反应生成CH2BrCH2Br,然后在NaOH水溶液中发生水解反应,生成HOCH2CH2OH;苯乙烯在酸性高锰酸钾条件下被氧化为苯甲酸,二者反应即可得目标产物.
解答 解:根据题中各物质的转化关系,结合信息提示①,以及反应①的条件可知,能生成 的B应为
的B应为 ,C应为CH2=CH2,A为
,C应为CH2=CH2,A为 ,苯在Br2/Fe条件下发生取代反应生成
,苯在Br2/Fe条件下发生取代反应生成 ,
, 与CH2=CH2发生反应②为取代反应生成
与CH2=CH2发生反应②为取代反应生成 ,
, 被高锰酸钾氧化得到D,根据信息提示②可知,D为
被高锰酸钾氧化得到D,根据信息提示②可知,D为 ,
, 与COCl2发生取代反应生成
与COCl2发生取代反应生成 ,
, 与双氧水、碳酸钠在催化剂条件下发生取代反应生成
与双氧水、碳酸钠在催化剂条件下发生取代反应生成 ,
,
(1)A为 ,物质A的名称为苯,物质C中含有的官能团的名称为碳碳双键,D的结构简式为
,物质A的名称为苯,物质C中含有的官能团的名称为碳碳双键,D的结构简式为  ,故答案为:苯;碳碳双键;
,故答案为:苯;碳碳双键; ;
;
(2)反应①~④中属于取代反应的有①②④,故答案为:①②④;
(3)反应②的化学反应方程式 +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr,
+HBr,
故答案为: +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr;
+HBr;
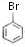
(4)某物质E为过氧化苯甲酰的同分异构体,E的同分异构体符合下列条件;
①含有联苯结构单元( );
);
②在一定条件下能发生银镜反应,且1mol E最多可得到4mol Ag,说明含有2个醛基;
③遇FeCl3溶液显紫色,说明含有酚羟基,1mol E最多可消耗3mol NaOH,则酯基水解生成羧基和酚羟基,
则符合条件的结构简式为 (苯环上基团位置可换)等,
(苯环上基团位置可换)等,
故答案为: (苯环上基团位置可换);
(苯环上基团位置可换);
(5)乙烯可以和溴水发生加成反应生成CH2BrCH2Br,然后在NaOH水溶液中发生水解反应,生成HOCH2CH2OH;苯乙烯在酸性高锰酸钾条件下被氧化为苯甲酸,二者反应即可得目标产物,所以其合成路线为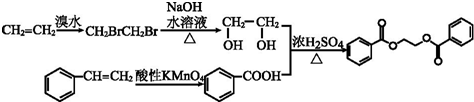 ,
,
故答案为: .
.
点评 本题考查有机物推断和有机合成,为高频考点,侧重考查学生分析推断及信息迁移能力、知识综合应用能力,根据反应条件、某些物质结构简式结合题给信息进行推断,难点是有机合成路线设计,需要学生熟练掌握基础知识并灵活运用,题目难度中等.


科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
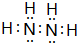 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 熔点/°C | 密度/ (g•cm-3) | 硬度(金刚 石为10) | 导电性 (银为100) |
| 某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1 535 | 7.86 | 4.5 | 17 |
| A. | 导线 | B. | 门窗框 | C. | 炉具 | D. | 飞机外壳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 正反应速率 | 逆反应速率 | |
| A | vA=2 mol/(L•min) | vB=2 mol/(L•min) |
| B | vA=2 mol/(L•min) | vC=2 mol/(L•min) |
| C | vA=1 mol/(L•min) | vB=2 mol/(L•min) |
| D | vA=1 mol/(L•min) | vC=1.5 mol/(L•min) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
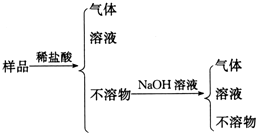
| A. | Al、Cu、Mg、Si | B. | Al、Mg、Si、Zn | C. | Al、Fe、C、Cu | D. | Al、Si、Zn、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
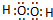 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H2<△H3<△H1 | D. | △H1=△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com