
| A. | Mg的金属性比Al强 | B. | H-的离子半径大于Li+ | ||
| C. | HCl的热稳定性比HF强 | D. | HClO4的酸性比H3PO4强 |
分析 A.Mg、Al均在第三周期,原子序数大的金属性弱;
B.具有相同电子排布的离子,原子序数大的离子半径小;
C.非金属性越强,氢化物越稳定;
D.非金属性越强,对应最高价氧化物水化物的酸性越强.
解答 解:A.Mg、Al均在第三周期,原子序数大的金属性弱,则Mg的金属性比Al强,故A正确;
B.具有相同电子排布的离子,原子序数大的离子半径小,则H-的离子半径大于Li+,故B正确;
C.非金属性F>Cl,HF的热稳定性比HCl强,故C错误;
D.非金属性Cl>P,HClO4的酸性比H3PO4强,故D正确;
故选C.
点评 本题考查元素在周期表的位置及应用,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重于学生的分析与应用能力的考查,注意同周期元素性质变化规律,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
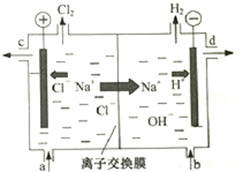 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属锗是一种良好的导热、导电材料 | |
| B. | 元素的非金属性越强,其氢化物的沸点越高 | |
| C. | 同周期相邻主族元素的原子,其质子数之差均为1 | |
| D. | 最外层电子数为4的原子,其元素一定处于ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,由2个原子组成的分子是HF、阴离子是OH-.
,由2个原子组成的分子是HF、阴离子是OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
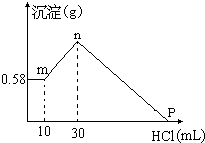
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、人造纤维和合成橡胶都属于有机高分子化合物 | |
| B. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 | |
| C. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂 | |
| D. | 草木灰和铵态氮肥不能混合使用,是因为NH4++HCO3-═CO2↑+H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
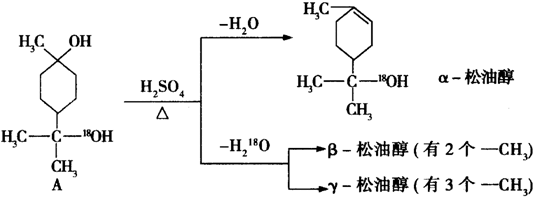
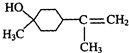 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$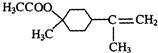 +H2O.
+H2O.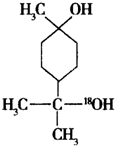 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$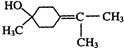 +H218O,该反应的反应类型是消去反应.
+H218O,该反应的反应类型是消去反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com