
| A. | 2、64、24 | B. | 16、50、24 | C. | 32、50、12 | D. | 64、2、24 |
分析 根据n=cV计算各物质的物质的量,进而计算混合液中各离子的物质的量,再根据离子守恒可知,n(K2SO4)=n(SO42-),n( KCl)=n( K+ ),n(NH4Cl)+n(KCl)=n( Cl- ),据此计算解答.
解答 解:50mol NH4Cl、16mol KCl和24mol K2SO4的无土栽培营养液中:n(K2SO4)=n(SO42-)=n((NH4)2SO4)=24mol;
n( KCl)=n( K+ )=16mol+24mol×2=64mol;
n(NH4Cl)+n(KCl)=n( Cl- )=50mol+16mol,n( KCl)=64mol;
n(NH4Cl)=66mol-64mol=2mol;
所以用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量分别为64mol、2mol、24mol,
故选D.
点评 本题考查溶液配制的基本原则,熟悉质量守恒定律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ③⑤⑥⑧ | C. | ②④⑦ | D. | 除②④⑦外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液中加入足量的乙酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 向氨基乙酸溶液中滴入NaOH溶液:H2NCH2COOH+OH-→H2NCH2COO-+H2O | |
| D. | 向氯化铁溶液中加入足量的铁:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
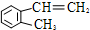 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.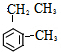 .
.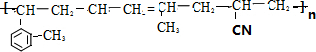 (假设按1:1:1的单体比例合成).
(假设按1:1:1的单体比例合成). ,制取写出相关的化学方程式:
,制取写出相关的化学方程式: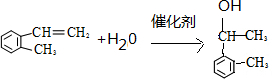 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+C2H5OH→CH3COOCH2CH3+H2O 取代反应 | |
| B. | CH2=CH2+O2→CH3COOH 加成反应 | |
| C. | CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O 酯化反应 | |
| D. | C6H6+HNO3→C6H5-NO2+H2O 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35% | B. | 70% | C. | 17.5% | D. | 0.035% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
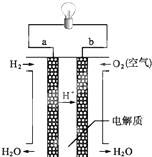 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com