
| A. | 由于CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池 | |
| B. | 工业上冶炼铝2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| D. | 理论上说,不能自发进行的氧化还原反应都可设计成原电池 |
分析 A.氧化还原反应可设计成原电池;
B.Al为活泼金属,电解熔融离子化合物制备Al;
C.燃料电池中原电池的两极相同;
D.能自发进行的氧化还原反应,且为放热的反应都可设计成原电池.
解答 解:A.氧化还原反应可设计成原电池,而CaO+H2O═Ca(OH)2中不含元素的化合价变化,不能设计成原电池,故A错误;
B.Al为活泼金属,电解熔融离子化合物制备Al,则工业上冶炼铝的反应为2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,故B正确;
C.燃料电池中原电池的两极相同,可均为Pt电极,则原电池的两极不一定是由活动性不同的两种金属组成,也可为金属与非金属电极,故C错误;
D.能自发进行的氧化还原反应,且为放热的反应都可设计成原电池,则理论上说,不能自发进行的氧化还原反应可设计成电解装置发生,故D错误;
故选B.
点评 本题考查原电池的设计及金属冶炼等,为高频考点,把握氧化还原反应与电化学的关系为解答的关键,注意选项C为解答的易错点,题目难度不大.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )
已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )| A. | 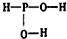 | B. | 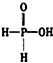 | C. | 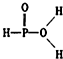 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
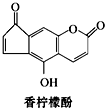
| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1 mol最多可消耗7 mol H2 | |
| C. | 它与溴水发生反应,1 mol最多消耗3 mol Br2 | |
| D. | 它与NaOH溶液反应,1 mol最多消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与H2S反应生成S | |
| B. | 溶于水时HCl是强酸,H2S是弱酸 | |
| C. | 受热时H2S能分解,HCl则不能 | |
| D. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com