
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
分析 热化学方程式的书写:标明物质的聚集状态;焓变符号中的“+”和“-”代表吸热和放热,化学反应的焓变和物质的量相对应.
解答 解:1g火箭燃料N2H4燃烧,生成N2和H2O(g),同时放出16.7kJ的热量,则1molN2H4燃烧放出的热量为:16.7kJ×$\frac{1mol×32g/mol}{1g}$=534.4kJ,反应热化学方程式可表示为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1,
A.没注明物质的聚集状态,故A错误;
B.没注明物质的聚集状态,且化学反应的焓变不正确,故B错误;
C.由上述分析可知,反应热化学方程式可表示为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1,故C正确;
D.0.5mol肼(N2H4)反应放出的热量为267.2kJ,焓变符号应为“-”,故D错误,
故选C.
点评 本题考查热化学方程式书写与判断,比较基础,注意掌握热化学方程书写规则.


科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 | |
| D. | 二氧化氮与水反应的离子方程式是3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可简写为
可简写为
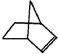
 ,系统命名为甲苯.
,系统命名为甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
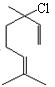 ;
;
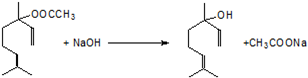 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:11 | B. | 5:6 | C. | 11:6 | D. | 6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:Br2>Cl2 | B. | 稳定性:HCl>HBr | ||
| C. | 酸性:H2SiO3>H2SO4 | D. | 碱性:Mg(OH)2<NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 氧气的质量为32g | |
| B. | 常温常压下,1mol CO2气体体积约为22.4L | |
| C. | CO2的摩尔质量为44g/mol | |
| D. | 1L 2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com