
(10��)ij��ѧѧϰС����ʵ������������ͼװ�òⶨ�кͷ�Ӧ�е���ЧӦ��ʵ��ʱ��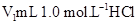 ��Һ��
��Һ��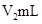 δ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ�¶ȣ�����ʵ����������ͼ��ʾ(ʵ����ʼ�ձ���
δ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ�¶ȣ�����ʵ����������ͼ��ʾ(ʵ����ʼ�ձ��� )��
)��
�ݴ���ش��������⣺
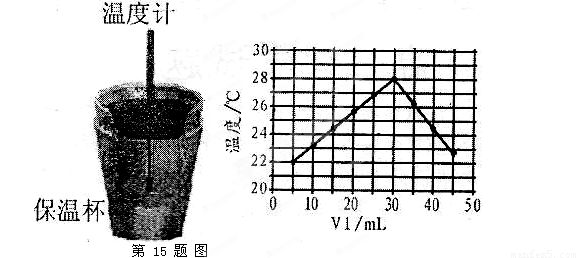 (1)��ʵ��װ���Ͽ�����ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________________________��
(1)��ʵ��װ���Ͽ�����ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________________________��
(2)���±���������_______________________________________________________��
(3)ijͬѧ�����������ݣ���������¹۵㣬������ȷ����______________________��
A������ʵ��ʱ�����¶�Ϊ22��
B����ʵ�������ѧ�ܿ���ת��Ϊ����
C����ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
(4)����ͼ���������ݣ��ɲ��NaOH��Һ��Ũ��ԼΪ______________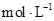
(5)����ʹ�ñ��±��⣬Ϊ�˱�֤ʵ��ɹ�����Ҫע����Щ����(˵��1�㼴
��) ____________________________
��1�����β�����������2����ֹ����ɢʧ��3��B ��4��1.5 ��5��ʹ�õ����������������Һ��Ũ��ҪС��Ҫ���¶ȼƵ�ˮ����Ҫ��ȫ������Һ�У��������֣���
����������1����Ӧʱ��Ҫ���裬���Ի�ȱ�ٻ��λ��ν������
��2����ʵ���У�Ӧ�þ����ܼ�����������ʧ�����Ա��±��������Ǽ�����������ʧ��
��3������ͼ���֪����V1=0ʱ����Һ���¶Ȳ���22�棬A����ȷ�����ŷ�Ӧ�Ľ��У���Һ���¶����ߣ����Է�Ӧ���ȣ�B��ȷ��ѡ��C��ʵ����ϵ������ȷ����ѡB��
��4�������ǡ�÷�Ӧʱ���ų���������࣬���Ը���ͼ����жϣ��������Ƶ�Ũ����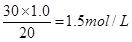 ��
��
��5����ʵ���У�Ӧ�þ����ܼ�����������ʧ������ʹ�õ����������������Һ��Ũ��ҪС��Ҫ���¶ȼƵ�ˮ����Ҫ��ȫ������Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
A��B��C��D�ֱ�������ֲ�ͬ��Ԫ�ء�Aԭ�ӵ����������Ų�Ϊns1��Bԭ�ӵļ۵����Ų�Ϊns2np2��Cԭ�ӵ�����������������Ӳ�����3����Dԭ�ӵ�L���Ӳ��p�����3�����ӡ�
��1��Cԭ�ӵĵ����Ų�ʽΪ ?? ����Aԭ�ӵ����������Ų�Ϊ1s1����ԭ�ӹ�����ص���ʽ�жϣ�A��C�γɵĻ������еĹ��ۼ��������� ?? ��A��C���γɵĻ�������۷е����Ը���A��C��ͬ����Ԫ�����γɵĻ�������۷е㣬��ԭ���� ?? ��
��2����n=2ʱ��Bԭ�ӵĽṹʾ��ͼΪ ?? ��B��C�γɵľ������� ���塣��n=3ʱ��B��C�γɵľ����У�Bԭ�ӵ��ӻ���ʽΪ ?? ���þ�������С�Ļ����� ?? �������ɣ�������������� ?? ��
��3����Aԭ�ӵ����������Ų�Ϊ4s1��Bԭ�ӵļ۵��Ų�Ϊ3s23p2��A��Ԫ�����ڱ��е�λ���� ?? ��A��B��C��D����Ԫ�صĵ�һ�������ɴ�С��˳����
?? ����Ԫ�ط��ű�ʾ����
B����ʵ�黯ѧ��12�֣�ij��ѧ�о���ѧϰС�������һϵ�С������ǵ�ľ̿��ȼ����ʵ�飬ʵ��װ������ͼ��ʾ��
 ��1������ͬѧ̽����ʹ������ľ̿��ȼʱO2����������ļ��ޡ����������Ϳ������ٶ�������O2���������Ϊ20%������ͬ������Ȼ�ϵ�100mL����A����ʵ�飬ʵ���¼���£�
��1������ͬѧ̽����ʹ������ľ̿��ȼʱO2����������ļ��ޡ����������Ϳ������ٶ�������O2���������Ϊ20%������ͬ������Ȼ�ϵ�100mL����A����ʵ�飬ʵ���¼���£�
| ��� | I | II | III | IV | V |
| V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
| V(����)/mL | 40 | 60 | 80 | 88 | 90 |
| ���� | ľ̿��ȼ | ľ̿��ȼ | ľ̿��ȼ | ľ̿��ʱȼ�գ���ʱ��ȼ�� | ľ̿ ����ȼ |
�ش��������⣺
��ʹ������ľ̿��ȼ��O2�����������СԼΪ ?? ��
���ô�����ľ̿���鼯��ƿ���Ƿ���O2����ľ̿��ȼ���ܷ���Ϊ����ƿ�������һ���Ǵ�����O2���� ?? ����ܡ�����
��������3��2�ı������O2��CO2���壬�û�������ܷ�ʹ�����ǵ�ľ̿��ȼ��
�� ?? �����ܡ�������һ��������
��2������ͬѧ̽����NO2�ܷ�֧��ȼ�ա������⣬��������¼���ʵ�飬ʵ���¼���������£�
| ��� | ��ȡ����A�����з�Ӧ�����Ļ�����壩 | B�е����� | ���� |
| a | ����ƿ�м�������ŨHNO3 4HNO3 �� 4NO2��+O2��+2H2O�� | ��������ɫ���壬ľ̿����ȼ������Ϩ�� | NO2��֧��ȼ�� |
| b | ����AgNO3���� 2AgNO3 �� 2NO2��+O2��+2Ag | ��������ɫ���壬ľ̿��ȼ | NO2֧��ȼ�� |
| c | ����Cu(NO3)2���� 2Cu(NO3)2 �� 4NO2��+O2��+2CuO | ��������ɫ���壬ľ̿��ȼ | NO2֧��ȼ�� |
����Ϊa��b��c���������Ƿ�ɿ���˵��������ɡ�
a�� ?? ��ԭ���� ?? ��
b�� ?? ��ԭ���� ?? ��
c�� ?? ��ԭ���� ?? ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ӱ�ʡ�������и߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ�ʵ����
(10��)ij��ѧѧϰС����ʵ������������ͼװ�òⶨ�кͷ�Ӧ�е���ЧӦ��ʵ��ʱ�� ��Һ��
��Һ�� δ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ�¶ȣ�����ʵ����������ͼ��ʾ(ʵ����ʼ�ձ���
δ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ�¶ȣ�����ʵ����������ͼ��ʾ(ʵ����ʼ�ձ��� )��
)��
�ݴ���ش��������⣺ (1)��ʵ��װ���Ͽ�����ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________________________��
(1)��ʵ��װ���Ͽ�����ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��________________________��
(2)���±���������_______________________________________________________��
(3)ijͬѧ�����������ݣ���������¹۵㣬������ȷ����______________________��
A������ʵ��ʱ�����¶�Ϊ22��
B����ʵ�������ѧ�ܿ���ת��Ϊ����
C����ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ
(4)����ͼ���������ݣ��ɲ��NaOH��Һ��Ũ��ԼΪ______________
(5)����ʹ�ñ��±��⣬Ϊ�˱�֤ʵ��ɹ�����Ҫע����Щ����(˵��1�㼴
��) ____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�˴��и�����ѧ�ڵ�����¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
���أ�H2NCONH2)���л�̬���ʣ���ũҵ���������ŷdz���Ҫ�����á�
��1����ҵ�Ϻϳ����صķ�Ӧ���������У�
��һ����2NH3(l)+CO2 H2NCOONH4(���������)(l) ��H1
H2NCOONH4(���������)(l) ��H1
�ڶ�����H2NCOONH4 (l)  H2O+ H2NCONH2(l) ��H2
H2O+ H2NCONH2(l) ��H2
ij��ѧѧϰС��ģ�ҵ�Ϻϳ����ص������������Ϊ1 L���ܱ�������Ͷ��4 mol NH3��1 mol CO2��ʵ���÷�Ӧ�и���ֵ����ʵ�����ʱ��ı仯����ͼI��ʾ��

��֪�ܷ�Ӧ�Ŀ������ɽ�����һ����Ӧ�����ġ���ϳ������ܷ�Ӧ�Ŀ����ɵ�______����Ӧ������ �ܷ�Ӧ���е�______minʱ����ƽ�⡣
�ڵڶ�����Ӧ��ƽ�ⳣ��K���¶ȵı仯������ͼII��ʾ����H2______0(�>������<����=������
��2����С�齫һ���������İ���������������Ƶ��ܱ����������(��������������䣬 ��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺
 ��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
|
�¶�/�� |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
ƽ����ѹǿ/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
ƽ��������Ũ��/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ��״̬�ı�־��____________��
A��2V(NH3)=V(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��Cʱ�÷ֽⷴӦ��ƽ�ⳣ��Ϊ______(����С�����һλ)��
��3����֪��
N2(g)+O2(g)=2NO(g) ��H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) ��H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) ��H3=-483.6KJ/mol
��4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)�ġ�H=___kJ • mol-1��
��4������ȼ�ϵ�صĽṹ��ͼ��ʾ���乤��ʱ �����缫��Ӧʽ�ɱ�ʾΪ______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ֣���и��������β���Ԥ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
���أ�H2NCONH2)���л�̬���ʣ���ũҵ���������ŷdz���Ҫ�����á�
��1����ҵ�Ϻϳ����صķ�Ӧ���������У�
��һ����2NH3(l)+CO2 H2NCOONH4(���������)(l) ��H1
H2NCOONH4(���������)(l) ��H1
�ڶ�����H2NCOONH4 (l)  H2O+ H2NCONH2(l) ��H2
H2O+ H2NCONH2(l) ��H2
ij��ѧѧϰС��ģ�ҵ�Ϻϳ����ص������������Ϊ1 L���ܱ�������Ͷ��4 mol NH3��1 mol CO2��ʵ���÷�Ӧ�и���ֵ����ʵ�����ʱ��ı仯����ͼI��ʾ��

����֪�ܷ�Ӧ�Ŀ������ɽ�����һ����Ӧ�����ġ���ϳ������ܷ�Ӧ�Ŀ����ɵ�______����Ӧ�������ܷ�Ӧ���е�______minʱ����ƽ�⡣
�ڵڶ�����Ӧ��ƽ�ⳣ��K���¶ȵı仯������ͼII��ʾ����H2______0(�>������<����=������
��2����С�齫һ���������İ���������������Ƶ��ܱ����������(��������������䣬 ��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺
 ��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
|
�¶�/�� |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
ƽ����ѹǿ/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
ƽ��������Ũ��/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ��״̬�ı�־��____________��
A��2V(NH3)=V(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��Cʱ�÷ֽⷴӦ��ƽ�ⳣ��Ϊ______(����С�����һλ)��
��3����֪��
N2(g)+O2(g)=2NO(g) ��H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) ��H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) ��H3=-483.6KJ/mol
��4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)�ġ�H=___kJ • mol-1��
��4������ȼ�ϵ�صĽṹ��ͼ��ʾ���乤��ʱ �����缫��Ӧʽ�ɱ�ʾΪ______��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com