
【题目】下列说法中正确的是
A.有能量变化的过程一定是化学变化过程 B.需要加热才能发生的反应是吸热反应
C.化学反应中一定伴有热量的变化 D.物质发生燃烧的反应一定是放热反应
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______,如果司机酒驾检查时该物质显示的颜色变化是_____________________。
(2)关于R单质晶体的说法正确的是______________。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:

已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________。
(4)W的原子半径为r,其晶体的空间利用率______________(用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______,中心原子的杂化方式为_____
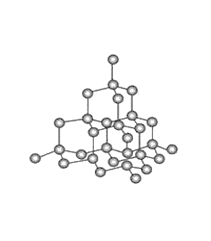
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别乙醇、苯和四氯化碳,最简单的方法是( )
A.加入金属钠,振荡,静置B.在有浓硫酸存在的条件下与乙酸加热
C.加蒸馏水后振荡,静置D.加硝酸银溶液后振荡,静置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Ⅵ)的化合物有较大毒性,如不回收利用,会对环境造成污染。某混合浆液含Al(OH)3、MnO2和少量Na2CrO4。某研究小组设计了如下电解分离装置,可以使浆液较完全地分离成固体混合物和含铬元素溶液,并回收利用。下列说法错误的是( )
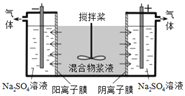
A. 通电后CrO42-将通过阴离子膜进入阳极室 B. 阴极室最终只能得到Na2SO4和H2
C. 阳极的电极反应式为:4OH--4e-=O2↑+2H2O D. 分离后所得含铬元素的粒子有CrO42-和Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为____________________;LiBH4中Li、B、H元素的电负性由大到小的排列顺序为_________________。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为____________。

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键__________(填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为__________。
②B、C、N与O元素的第一电离能由大到小的顺序为___________________。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作___________(选填下列字母序号)。
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为________________;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是_______________。
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
①该金属元素是___________(填元素符号)..
②若氢化物的晶胞结构如图所示(有4个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为__________cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
![]()
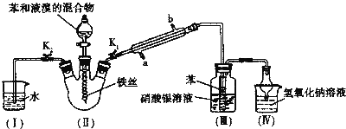
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____。能说明苯与液溴发生了取代反应的现象是_____。Ⅳ中球形干燥管的作用是_____。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再_____,这样操作的目的是_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24
B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单二苯乙炔类化合物是![]() 。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
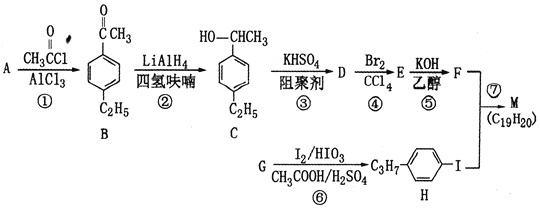
回答下列问题:
(1)G的结构简式为________________。
(2)C中含有的官能团名称是________________________。
(3)反应②的反应类型是________________,反应⑥的反应类型是________________。
(4)反应⑤的化学方程式为____________________。
(5)能同时满足下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有两个取代基 ②能发生银镜反应
写出其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式_______。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线。_________________________
的合成路线。_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com