
| A. | 活性炭、C60、金刚砂都是碳的同素异形体 | |
| B. | Fe2O3、Na2O2、K2O都是碱性氧化物 | |
| C. | 淀粉、蛋白质、油脂都属于有机高分子化合物 | |
| D. | 纯碱、氯化铵、明矾都是盐且都属于强电解质 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 向容器中充入He气 | X的转化率变大 |
| B | 增大压强 | X的浓度变大 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
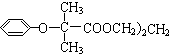
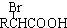 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$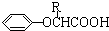
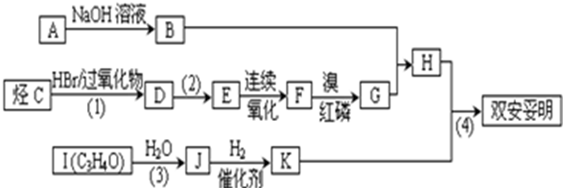
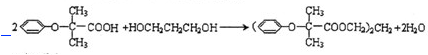
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用露天焚烧方法处理塑料废弃物 | |
| B. | 利用高纯单质硅制成太阳能电池 | |
| C. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
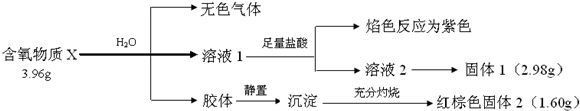
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256 g S8分子中含S-S键为7NA个. | |
| C. | 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com