
(10��)��1.52gͭþ�Ͻ���ȫ�ܽ���50.0mL�ܶ�Ϊ1.40g/mL����������Ϊ63.0%��Ũ�����У��õ�NO2��N2O4 �Ļ������1120mL (��״��)����Ӧ�����Һ�м���1.00mol/LNaOH��Һ,����������ȫ������ʱ���õ�2.54g��������
��1��Ũ������HNO3�����ʵ���Ũ�ȡ�
��2���úϽ���ͭ��þ�����ʵ���֮��Ϊ ��
��3�� NO2��N2O4 �Ļ�������У�NO2 ����������� ��
��1��C(HNO3)=14mol/L����2��2:1����3��80%
��������
�����������1�����ݽ��������ʵ���Ũ�������������Ļ����ϵ��֪:C=(�ѡ�1000����)��M =(1.40��1000��63.0%) ��63=14mol/L���ڻ�ѧ��Ӧ�н���ʧȥ�ĵ��ӵ����ʵ�����������õ��ĵ��ӵ����ʵ��������γɳ���ʱ�����������ӵ����ʵ�����ͭþ����+2�۵Ľ������������ӵ���������OH-��������m(OH-)= 2.54g-1.52g=1.02g��n(OH-)=1.02g��17g/mol=0.06mol.��n(Mg)+n(Cu)=0.03mol.��Ϊ24 n(Mg)+64n(Cu)= 1.52��n(Mg)=0.01mol; n(Cu)=0.02mol.���ԸúϽ���ͭ��þ�����ʵ���֮��Ϊ0.02:0.01=2:1.��3��1120mL�����������ʵ�����0.05mol������NO2��N2O4 �Ļ�������У�NO2 �����ʵ�����x,��N2O4 �����ʵ�����(0.05-x)mol.���ݵ����غ�ɵ�x+2(0.05-x)= 0.06mol.���x=0.04mol.����������˵�����������ȵ������ǵ����ʵ����ıȡ�����NO2 �����������(0.04mol��0.05mol)��100%=80%��
���㣺�����غ㷨��������ԭ��Ӧ�е�Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014��������һ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ���ҿ���ͨ���Ҵ������ڵ���ˮ��Ӧ����ϩ����Ӧ����ʽ���£�

���д���������Ҳ�ܷ������Ƶ���ˮ��Ӧ����ϩ������
A�� B��CH3OH C��
B��CH3OH C�� D��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ɳ�и����߿���ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������и�ͼ��˵���У���ȷ����

A���������Դ���������ĵ缫�����ܲ���ʹʪ�����KI��ֽ����������
B�����д�������ƷӦ�����Դ������������
C�����е�b���ǵ��������ļ�������������Ӧ
D�����е����ӽ���Ĥ���Ա������ɵ�Cl2��NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����ظ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ȼ���ڵĽ����գ�Fr������������21����֪ͬλ�ض��з����ԡ����Ǽ����Ԫ�������ص�Ԫ�ء������������ڱ��е�λ��Ԥ�������ʣ����в���ȷ����( )
A���ڿ�����ȼ��ʱ����������Fr2O B������֪Ԫ���о�������ԭ�Ӱ뾶
C���������Ӧ��ˮ������Լ�ǿ D���䵥�ʵ��۵�Ƚ����Ƶ��۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����ظ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ���ǣ� ��
A���������еμӰ�ˮ��H++OH��=H2O
B��Fe(OH)3��������Fe(OH)3+3H+=Fe3++3H2O
C��ͭ����ϡ���3Cu+8H++2NO3��=3Cu2��+2NO��+4H2O
D��Na2S2O3��Һ��ͨ������������S2O32����2Cl2��3H2O��2SO32����4Cl����6H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����ظ�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��£�����̶����ܱ������н��п��淴ӦA(g) + 3B(g) 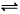 2C(g) �����й��ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��˵���в���ȷ����
2C(g) �����й��ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��˵���в���ȷ����
A����λʱ��������n mol A��ͬʱ����3n mol B
B��A��B��C��Ũ�Ȳ��ٷ����仯
C����������ѹǿ���ٷ����ı�
D��C���ɵ�������C�ֽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����ظ�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪Rԭ����b�����ӣ�R2+������a�����ӡ���ʾRԭ�ӷ�����ȷ����( )

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��֪�л���ס��ҡ�����������Ϣ��
| �� | �� | �� |
����Ԫ�� | C��H | C��H��F | C��H��F |
���������� | 26 | ||
�ṹ�ص� | �����л��� | ||
�ݴ��ƶϣ�
��1���ķ���ʽΪ ������������2����ԭ�ӱ�Fԭ��ȡ�������õ��л���������� �֡�
��2���������������Ļ�������ɴ���ijЩ�ƻ�������ķ�������Ʒ������������������C��H��F��ԭ�Ӹ���֮��Ϊ1:2:2�����ҵĽṹʽΪ �����й����ҵ�������ȷ���� ��
A������ӹ���Ϊ���������� B������ʹ��ˮ��ɫ
C��1 mol ���������1 mol F2 ����ȡ����Ӧ D����û��ͬ���칹��
��3�����ס��Ұ����ʵ���֮��1:1��ϣ����û�����ƽ��Ħ���������ڱ���Ħ���������ұ����Ӳ�����ͬ���칹�壬����ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��15�֣�
���Ȼ��ף�PCl3����һ����Ҫ���л��ϳɴ�����ʵ���ҳ��ú���������Cl2��ȡPCl3��װ������ͼ��ʾ��

��֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��O2������POCl3(��������)�� POCl3����PCl3��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl��PCl3��POCl3���۷е���±���
���� | �۵�/�� | �е�/�� |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
��ش�
��1��д��A�з�Ӧ�����ӷ���ʽ ��
��2��Bװ������ʢ�Լ��� ��E���ձ�����ˮ�������� ��
��3��ʵ��ǰ������֮��������Ҫ�õ���Ƥ�ܣ������ӷ����ǣ��Ȱ� ��Ȼ�������������ɰѲ����ܲ�����Ƥ���С�
��4�����װ�������Ժ���Dװ�õ�����ƿ�м�����ף���K3ͨ������CO2��һ��ʱ���ر�K3����������ƿ���ϲ��л�ɫ���������ʱͨ����������Ӧ�������С�����ͨ�����CO2��Ŀ���� ��
��5��ʵ���ƵõĴֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5����ͨ�� ����ʵ�����ƣ����ɵõ��ϴ�����PCl3��
��6��ʵ���ر�K1����K2����A��B������ͨ��300ml 1mol/L��NaOH��Һ�С���NaOHǡ����ȫ��Ӧ�����������������ʵ���Ϊ�����跴Ӧ������NaCl �� NaClO �� NaClO3 �����Σ� mol����Ӧ��ת�Ƶ��ӵ����ʵ���(n)�ķ�Χ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com