
【题目】实验室中用图1所示的装置进行氨气的喷泉实验,实验结束后的情况如图2所示,下列说法正确的是
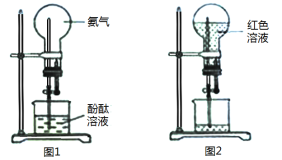
A.需要用热毛巾覆盖烧瓶底引发喷泉实验
B.红色溶液未充满是因为装置漏气
C.烧瓶中溶液呈红色是因为氨气能电离出OH-
D.若在标准状况下进行该实验,得到氨水的浓度是1/22.4mol·L-1
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O (方程式中H为+1价,O为-2价)下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O (方程式中H为+1价,O为-2价)下列说法正确的是( )
A.KClO3在反应中失电子B.ClO2是氧化产物
C.H2C2O4在反应中被氧化D.1 molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列叙述正确的是( )
为阿伏加德罗常数的值。下列叙述正确的是( )
A.![]() 乙烷分子中含有的共价键数目为
乙烷分子中含有的共价键数目为![]()
B.![]() 完全溶于水转移的电子数为
完全溶于水转移的电子数为![]()
C.标准状况下,![]() 含有的原子数为
含有的原子数为![]()
D.![]() 乙烯和丙烯的混合物中含有的质子数为
乙烯和丙烯的混合物中含有的质子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,两种钠盐![]() 、
、![]() 溶液的物质的量浓度均为
溶液的物质的量浓度均为![]() ,加水稀释时溶液的
,加水稀释时溶液的![]() 与稀释倍数的对数
与稀释倍数的对数![]() 的关系如图所示。下列判断错误的是( )
的关系如图所示。下列判断错误的是( )
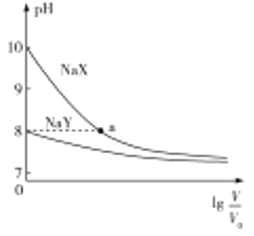
A.![]() 、
、![]() 均为弱酸,且
均为弱酸,且![]() 的酸性比
的酸性比![]() 的强
的强
B.![]() 的
的![]() 、
、![]() 溶液中,前者对水的电离促进作用较大
溶液中,前者对水的电离促进作用较大
C.![]() 点
点![]() 溶液中存在:
溶液中存在:![]()
D.随着溶液的稀释,![]() 溶液中
溶液中![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜片与浓硫酸反应后,铜片表面变黑,为研究该黑色物质的成分,某化学兴趣小组查阅资料得知:该黑色物质可能含CuO、CuS、Cu2S及有可能被黑色掩盖颜色的Cu2O(砖红色)。该兴趣小组通过图1所示实验流程对该黑色物质的成分进行探究,其中步骤![]() 在图2装置中进行。
在图2装置中进行。
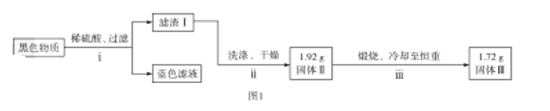
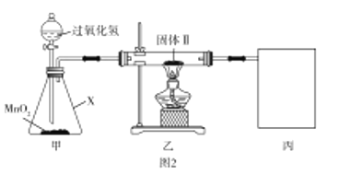
已知:Cu2O在酸中不稳定,生成Cu2+和Cu;铜的硫化物难溶于稀硫酸。回答下列问题:
(1)若测得滤渣Ⅰ中含Cu,写出“黑色物质”中加入稀硫酸发生反应生成Cu的离子方程式:__________。
(2)检验图2中整套装置气密性的方法是__________,仪器![]() 的名称是__________。
的名称是__________。
(3)步骤![]() 中检验固体Ⅱ洗涤干净的方法是__________。
中检验固体Ⅱ洗涤干净的方法是__________。
(4)通过计算确定固体Ⅱ中一定存在的硫化物是__________(写化学式)。
(5)为防止环境污染,丙装置可选用下列装置中的__________(填标号)
a.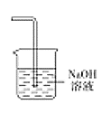 b.
b.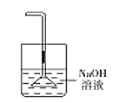 c.
c.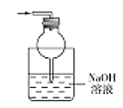 d.
d.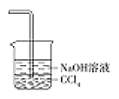
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
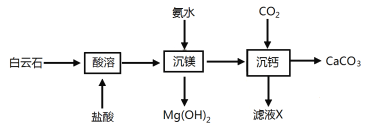
下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备并收集干燥、纯净氯气的装置如图所示:

(1)写出实验室制备Cl2的化学方程式:___。
(2)写出指定试剂的名称,C__,D__。
(3)C的作用是__,D的作用是__,F的作用是___。
(4)检验氯气是否收集满的操作:___。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是___,若反应产生0.5mol Cl2,则消耗的氧化剂的物质的量为___mol,反应转移的电子数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2![]() I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______。
②已知 Fe3++6F-![]() [FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________。
②步骤iii中判定滴定终点的现象是_____________。
(4)经小组测定,废液中c(Cu2+)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com