
| A. | 纯碱去油污 | B. | 明矾净水 | C. | 铝冶炼金属 | D. | 漂粉精漂白织物 |
科目:高中化学 来源: 题型:多选题
| A. | 金属性:丙>甲 | |
| B. | 原子半径:r(丁)>r(丙)>r(乙)>r(甲) | |
| C. | 乙、丙、丁的简单离子的电子层结构相同 | |
| D. | 甲和乙以1:4形成的简单阳离子含11个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
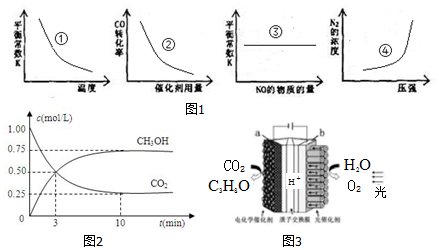
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
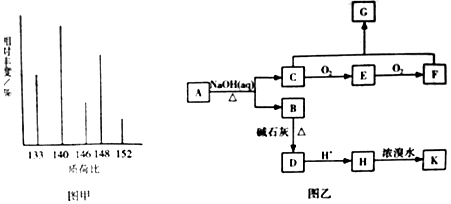
 、K
、K .
. .(本题不考虑
.(本题不考虑 结构).
结构).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
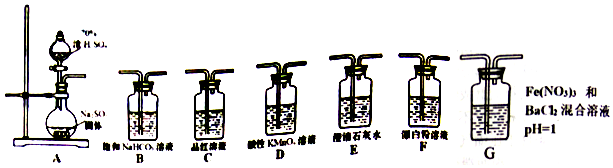
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8g | B. | 1.6g | C. | 2.4g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Na2S有强还原性 | 用于除去废水中的Cu2+和Hg2+ |
| B | CaCO3是难溶物 | CaCl2溶液中通入CO2产生白色沉淀 |
| C | Zn具有还原性和导电性 | 可用作锌锰干电池的负极材料 |
| D | 浓H2SO4有强氧化性 | 浓H2SO4可用于干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Al3+、SO42-、SiO32- | |
| B. | 碱性溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 与Al反应能放出H2的溶液中:Na+、Fe2+、ClO-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com