
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
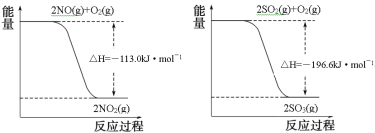
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
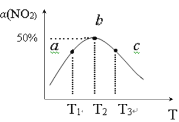
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
【答案】SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8kJ·mol-1 < 0.025mol·L-1·min-1 0.50 不变 温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小 c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】
(1)根据两幅图写出各自的热化学方程式再根据盖斯定律书写出正确的SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式;
(2)①温度越高,反应速率越快,由此判断;
②通过NO2的转化率计算转化的物质的量,再根据三段法计算反应速率和平衡常数;在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,由于温度不变,平衡常数不发生变化,据此利用三段法进一步计算转化率;
③根据影响平衡移动的因素进行分析;
(3)由数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液碱性越强,因此吸收液呈中性时,n(SO32-):n(HSO3-)<1:1,且中性时c(H+)=c(OH-),结合电荷守恒可得c(Na+)=2c(SO32-)+c(HSO3-),据此判断;
(1)根据两图可知热化学方程式为:①2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ/mol,②2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6kJ/mol,②-①可得:SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8kJ·mol-1;
(2)①温度越高,反应速率越快,所以有υ(a)<υ(c);
②温度为T2时从反应开始经过2min达到b点,NO2的转化率为50%,设NO2的转化了x mol/L,
SO2(g) + NO2(g) = SO3(g) + NO(g)
始(mol/L) 0.15 0.1 0 0
转(mol/L) x x x x
平(mol/L) 0.15-x 0.1-x x x
则有:![]() ×100%=50%,解得x=0.05,
×100%=50%,解得x=0.05,
那么用SO3表示这段时间的反应速率v=![]() =
=![]() =0.025mol·L-1·min-1;
=0.025mol·L-1·min-1;
K=![]() =
=![]() =0.50;
=0.50;
SO2(g) + NO2(g) = SO3(g) + NO(g)
始(mol/L) 0.40 0.25 0.05 0.05
转(mol/L) y y y y
平(mol/L) 0.40-y 0.25-y 0.05+y 0.05+y
由于温度不变,平衡常数不发生变化,则有
K=![]() =
=![]() =0.50,解得y=0.125mol/L
=0.50,解得y=0.125mol/L
NO2的转化率=![]() ×100%=50%,转化率不变;
×100%=50%,转化率不变;
③温度为T2时,达到平衡的点为b点,T2前,温度升高,反应速率加快,NO2转哈氨氯增大,T2以后,该反应为放热反应,温度升高,平衡逆向移动,转化率减小。
(3)由数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液碱性越强,因此吸收液呈中性时,n(SO32-):n(HSO3-)<1:1,且中性时c(H+)=c(OH-),结合电荷守恒可得c(Na+)=2c(SO32-)+c(HSO3-),因此溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
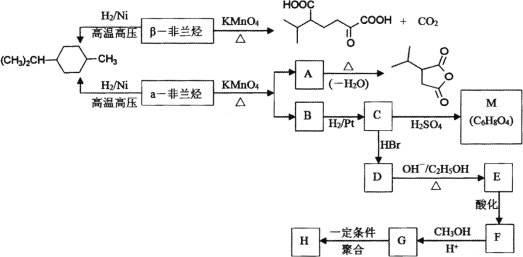
【题目】薄荷油中含有少量的α非兰烃和β非兰烃,两者互为同分异构体,其相对分子质量为136。根据如下转化,回答相关问题:
已知:
![]()
![]()
![]() +RCHO
+RCHO
![]()
![]()
![]() +CO2
+CO2
2CH3COOH![]()
![]()
(1) 写出α非兰烃中官能团名称________,β非兰烃的结构简式________。
(2) 下列有关说法正确的是________。
A.α非兰烃与等物质的量的Br2进行加成反应,产物共有3种
B.C→D和E→F反应类型相同
C.聚合物H易溶于水
D.C→M反应过程中有高分子聚合物等副产物产生
(3) 写出F→G的化学方程式________。
(4) 写出符合下列条件的A的同分异构体________。
①含有4个-CH3;②1 mol此同分异构体在碱性条件下水解需2 mol NaOH。
(5) 以甲苯和丙烯为基本原料合成![]() (用流程图表示,其他无机试剂任选)________。
(用流程图表示,其他无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、R五种元素均位于周期表的前四周期,且原子序数依次增大。元素X的基态原子中电子占据了三种能量不同的原子轨道,且成对电子数是未成对电子数的2倍;元素Y与W同主族,且Y是地壳中含量最多的元素;Z基态原子有12种不同运动状态的电子;元素R基态原子最外层只有1个电子且内层电子全充满。
请回答下列问题:(答题时,X、Y、Z、W、R用所对应的元素符号表示)
(1)基态Y原子的轨道式表示式为![]() ___。
___。
(2)元素Y、W均可形成含18个电子的氢化物,其中Y的氢化物沸点较高,原因是___;
(3)元素Z与同周期相邻两元素第一电离能由高到低的顺序为___。
(4)元素R在周期表中位于___区,R分别与Y、W形成离子化合物R2Y和R2W,其中熔点较高的为___。
(5)R2+与过量的氨水形成的配离子的化学式为[R(NH3)4]2+,在配离子中与R2+形成配位键的原子是___。
(6)X的一种单质(相邻原子间通过共价键形成空间网状结构)、XY2、WY2、ZW对应的晶体熔沸点由高到低的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有c(CH3COOH)+c(CH3COO)=0.1 mol·L1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是
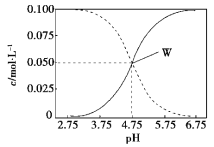
A. pH=5.5的溶液中:c(CH3COO—)>c(CH3COOH)>c(H+)>c(OH)
B. pH=3.5的溶液中:c(Na+)+c(H+)c(OH)+c(CH3COOH)=0.1 mol·L1
C. W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)
D. 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是_______。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中![]() 含氧气8 g/L的溶解氧,需要肼的质量为__________。
含氧气8 g/L的溶解氧,需要肼的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的有几项![]()
![]() 固体与稀硝酸混合:
固体与稀硝酸混合:![]()
![]() 用过量氨水吸收烟道气中的
用过量氨水吸收烟道气中的![]() :
:![]()
![]() 将少量
将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
![]() 已知
已知![]() ,向NaClO溶液中通入少量
,向NaClO溶液中通入少量![]() :
:![]()
![]() 铁屑溶于足量稀硝酸:
铁屑溶于足量稀硝酸:![]()
![]() 氯气溶于水:
氯气溶于水:![]()
![]() 实验室用
实验室用![]() 和
和![]() 制氨气:
制氨气:![]()
![]()
![]()
![]() 向
向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至
溶液至![]() 恰好沉淀完全:
恰好沉淀完全:![]()
![]() 实验室制
实验室制![]() :
:![]() 浓
浓![]() 十
十![]()
![]()
![]()
![]() 溶液刻蚀铜制电路板:
溶液刻蚀铜制电路板:![]()
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:①量取25.00mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-
滴定次数 | 待测液的体积/mL | 0.1000mol·L-1 Na2S2O3的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
试回答:
(1)消耗Na2S2O3的体积平均值为___mL,水中溶解氧的量是(以g/L为单位,保留3位有效数字)___。
(2)滴定(I2和S2O32-反应)以淀粉溶液为指示剂,终点时现象为___。
(3)判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质___。
④待测液的滴定管之前有气泡,取液后无气泡___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把SO2通入盛有H2S的溶液中出现淡黄色浑浊,该反应的化学方程式为____________________。
(2)将二氧化硫通入氯化钡溶液无现象,滴入新制的氯水有白色沉淀生成,写出反应的离子方程式:_________________________。
(3)硫酸亚铁铵[(NH4)2Fe(SO4)2]隔绝空气加热至500℃时能完全分解,分解产物中含有氧化铁、二氧化硫、氨气、氮气和水蒸气,反应的化学方程式为__________________。
(4)向氯化铜溶液中通入SO2,加热生成CuCl白色沉淀,离子方程式为___________________。
(5)把氧气通入Cu与浓硫酸反应后剩余的溶液中,铜片继续溶解,反应的化学方程式为________________________________________。
(6)①磷化氢(PH3)通入盛有Fe2(SO4)3溶液的试管中,颜色由棕黄色变成淡绿色,同时还有白色蜡状固体生成,反应的离子方程式是____________________。
②PH3有剧毒,用CuSO4溶液吸收,生成物中有Cu3P、H3PO4,写出反应的化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种药物在临床上有许多的应用,具有去热、镇痛等疗效,以下是该药物的合成路线:
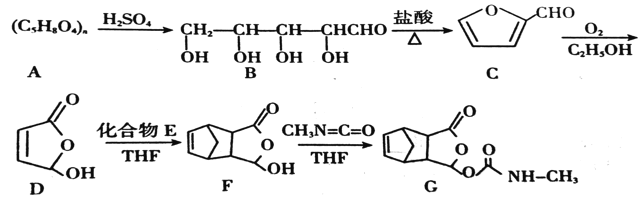
已知:CH2=CH—CH2=CH2+CH2=CH2![]()
(1)化合物C的分子式为__,B中含氧官能团的名称是__。
(2)E的一氯代物有__种,F→G的反应类型为__。
(3)写出D→F的化学方程式__。
(4)F的同分异构体有多种,符合以下条件的同分异构体有__种,写出其中一种的结构简式__。
①属于二取代芳香化合物,苯环上的一氯代物有两种
②能与FeCl3溶液发生显色反应
③能与碳酸氢钠反应产生气体
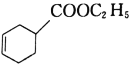
(5)写出由2—溴丁烷、丙烯酸和乙醇为原料合成如图物质的合成路线:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com